Hvorfor kan ikke partiklerne af en solid bevægelse væk fra hinanden?
* ioniske bindinger: Disse forekommer mellem modsat ladede ioner, som i bordsalt (NaCl).
* kovalente obligationer: Disse forekommer, når atomer deler elektroner, som i diamant (C).
* Metalliske obligationer: Disse forekommer mellem metalatomer, hvor elektroner deles frit gennem strukturen, som i kobber (Cu).
Disse kræfter er stærkere end den kinetiske energi fra partiklerne, hvilket normalt ville få dem til at bevæge sig frit. Dette betyder, at partiklerne er låst i en fast, stiv struktur og kan kun vibrere på plads.
Her er en simpel analogi:Forestil dig en gruppe mennesker, der holder hænderne tæt. De kan stadig vrikke lidt, men de kan ikke bevæge sig langt fra hinanden, fordi de er låst sammen.
Key Takeaway: Partiklerne i et fast stof er bundet sammen af stærke kræfter og forhindrer dem i at bevæge sig langt fra hinanden.
 Varme artikler
Varme artikler
-
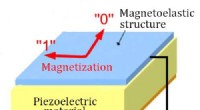 Forskere skaber magnetisk RAMMELRAM struktur. Kredit:MIPT MIPT-forskere gik sammen med samarbejdspartnere for en vellykket demonstration af magnetoelectric random access memory (MELRAM). En overgang til magnetoelektrisk hukom
Forskere skaber magnetisk RAMMELRAM struktur. Kredit:MIPT MIPT-forskere gik sammen med samarbejdspartnere for en vellykket demonstration af magnetoelectric random access memory (MELRAM). En overgang til magnetoelektrisk hukom -
 En ny måde at kontrollere qubits påKredit:CC0 Public Domain Et forskerhold, der omfatter to UO-fysikere, har skitseret nye teknikker til at kontrollere byggestenene i kvanteberegning, et potentielt vigtigt skridt i retning af at gø
En ny måde at kontrollere qubits påKredit:CC0 Public Domain Et forskerhold, der omfatter to UO-fysikere, har skitseret nye teknikker til at kontrollere byggestenene i kvanteberegning, et potentielt vigtigt skridt i retning af at gø -
 Følg ICARUS neutrinodetektorens fantastiske rejseICARUS-detektoren, set her i et renrum på CERN, er ved at blive forberedt på sin rejse til Fermilab. Kredit:CERN Den har levet i to forskellige lande, og det er ved at komme til en tredje. Det er
Følg ICARUS neutrinodetektorens fantastiske rejseICARUS-detektoren, set her i et renrum på CERN, er ved at blive forberedt på sin rejse til Fermilab. Kredit:CERN Den har levet i to forskellige lande, og det er ved at komme til en tredje. Det er -
 Reaktion af en kvantevæske til fotoekscitation af opløste partikler observeret for første gangMarkus Koch (2. i venstre række), Wolfgang Ernst (4. i venstre række), Bernhard Thaler (1. i højre række) og teamet ved Institute of Experimental Physics i TU Graz opnåede et gennembrud inden for fors
Reaktion af en kvantevæske til fotoekscitation af opløste partikler observeret for første gangMarkus Koch (2. i venstre række), Wolfgang Ernst (4. i venstre række), Bernhard Thaler (1. i højre række) og teamet ved Institute of Experimental Physics i TU Graz opnåede et gennembrud inden for fors
- Luftforurening dræber over 500, 000 europæere om året:rapport
- Klimaændringer forværrer tørke, reducere majsudbyttet i Afrika
- Hvad kan videnskabsmanden vide om, om mikroskop ikke blev opfundet?
- Undersøgelse finder fejl i førende træningsværktøj til løgnedetektion i sikkerhed
- Hvordan din hyggelige fleece kunne forurene havet
- Ny forskning afslører, hvordan Brasilien producerede mere mad, mens de reddede sine regnskove


