Hvad er partikelteorien om at opløse?
Partikelteorien om opløsning:En sammenbrud
Partikelteorien om opløsning forklarer, hvordan stoffer nedbrydes og blandes på molekylært niveau, når de opløses. Her er en forenklet forklaring:
1. Partikler i bevægelse: Alt stof er lavet af små partikler kaldet atomer og molekyler. Disse partikler er konstant i bevægelse, vibrerer og bevæger sig rundt.
2. Tiltrækning og frastødelse: Partikler tiltrækkes af hinanden af kræfter kaldet intermolekylære kræfter. Styrken af disse kræfter bestemmer stoftilstanden (fast, flydende eller gas). For eksempel har faste stoffer stærke intermolekylære kræfter, der holder dem sammen i en fast form.
3. Opløsning som en proces: Når et stof opløses, bryder partiklerne af det opløste stof (stoffet opløses) væk fra hinanden og bliver omgivet af partikler af opløsningsmidlet (stoffet, der gør opløsningen). Dette sker, fordi:
* tiltrækning mellem opløst stof og opløsningsmiddelpartikler: Opløsningsmidlets partikler har en stærkere tiltrækning til de opløste partikler end de opløste partikler har til hinanden.
* svækkelse af intermolekylære kræfter: Bevægelsen af opløsningsmiddelpartikler forstyrrer de intermolekylære kræfter, der holder opløsningspartiklerne sammen.
4. Typer af opløsning:
* ioniske forbindelser: Ioniske forbindelser (som salt) er lavet af ladede ioner. Når de opløses, adskiller ionerne sig og bliver omgivet af opløsningsmiddelmolekyler.
* kovalente forbindelser: Kovalente forbindelser (som sukker) er lavet af molekyler. Når de opløses, bliver molekylerne omgivet af opløsningsmiddelmolekyler, og de intermolekylære kræfter mellem dem svækkes.
5. Faktorer, der påvirker opløsning:
* Temperatur: Højere temperatur betyder mere kinetisk energi, som hjælper med at bryde de opløste partikler fra hinanden.
* overfladeareal: Et større overfladeareal af opløsningen betyder mere kontakt med opløsningsmidlet, hvilket fører til hurtigere opløsning.
* omrøring: Omrøring øger kontakten mellem opløst stof og opløsningsmiddel og accelererer opløsningsprocessen.
6. Opløselighed: Ikke alle stoffer opløses i alle opløsningsmidler. Opløselighed henviser til den maksimale mængde opløst stof, der kan opløses i en given mængde opløsningsmiddel ved en bestemt temperatur.
Kortfattet: Partikelteorien om opløsning hjælper os med at forstå, hvordan stoffer bryder sammen og blandes på et molekylært niveau. Det understreger vigtigheden af partikelbevægelse, tiltrækning og samspillet mellem opløst stof og opløsningsmiddel.
 Varme artikler
Varme artikler
-
 Nyt koncept for raketpropeller udnytter mekanismen bag solfaklerPPPL -fysiker Fatima Ebrahimi foran en kunstners opfattelse af en fusionsraket. Kredit:Elle Starkman (PPPL Office of Communications) og ITER En ny type raketpropeller, der kunne føre menneskeheden
Nyt koncept for raketpropeller udnytter mekanismen bag solfaklerPPPL -fysiker Fatima Ebrahimi foran en kunstners opfattelse af en fusionsraket. Kredit:Elle Starkman (PPPL Office of Communications) og ITER En ny type raketpropeller, der kunne føre menneskeheden -
 Gennembrud kan muliggøre billigere infrarøde kameraerFotos taget af forskere, der testede en ny metode til at lave et infrarødt kamera, der kunne være meget billigere at fremstille. Kredit:Xin Tang et al Der er en hel verden, vores øjne savner, sk
Gennembrud kan muliggøre billigere infrarøde kameraerFotos taget af forskere, der testede en ny metode til at lave et infrarødt kamera, der kunne være meget billigere at fremstille. Kredit:Xin Tang et al Der er en hel verden, vores øjne savner, sk -
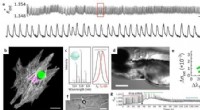 Biosensing med lasere i hviskende galleritilstanden, Enkeltcelleovervågning med en intracellulær mikrolaser. b, 3D-arrangement af myofibriller omkring mikroperler i neonatale kardiomyocytter (CMer). Cellekerne (magenta) og mikrolaser (grøn). c, WGM-
Biosensing med lasere i hviskende galleritilstanden, Enkeltcelleovervågning med en intracellulær mikrolaser. b, 3D-arrangement af myofibriller omkring mikroperler i neonatale kardiomyocytter (CMer). Cellekerne (magenta) og mikrolaser (grøn). c, WGM- -
 En scanning-type scanning nearfield optisk mikroskop undersøger materialer i nanoskalaenLektor Long Ju (i midten) og kolleger har bygget en ny, tilpasset version af et laboratorieværktøj kendt som nærfelts infrarød nanoskopi og spektroskopi til MIT-brugere. Den og en tidligere version, o
En scanning-type scanning nearfield optisk mikroskop undersøger materialer i nanoskalaenLektor Long Ju (i midten) og kolleger har bygget en ny, tilpasset version af et laboratorieværktøj kendt som nærfelts infrarød nanoskopi og spektroskopi til MIT-brugere. Den og en tidligere version, o
- Billede:Første lys fra HyperScout imager
- Hvad hedder et stykke rock indlejret i Igneous Rock?
- Hvad er forskellene mellem en plante og en dyrecelle under et mikroskop?
- Ford siger, at USA har åbnet en strafferetlig undersøgelse over køretøjers emissioner
- TikToker i rummet:Virgin Galactic sender en kendt forsker op
- Sådan konverteres kortgitterkoordinater til Latitude & Longitude


