Forklar effekten af temperatur på hastighed, der opløses ved hjælp af partikelteori.?
Temperatur og opløsning:Et partikelperspektiv
Effekten af temperatur på opløsning kan forklares smukt ved hjælp af partikelteorien:
1. Øget temperatur, øget kinetisk energi:
* Partikelteori: Partikler i et stof bevæger sig konstant, og denne bevægelse øges med temperaturen. Højere temperaturer betyder, at partikler har mere kinetisk energi.
* Effekt på opløsning: Denne øgede energi får partiklerne til at bevæge sig hurtigere og kollidere oftere. Partiklerne i opløstelsen (hvad der opløses) vil interagere oftere med opløsningsmidlets partikler (hvad der gør opløsningen). Denne øgede kollisionsfrekvens fører til hurtigere brud på bindinger mellem opløste partikler og hurtigere dannelse af bindinger mellem opløst stof og opløsningsmiddelpartikler.
2. Hurtigere opløsning:
* Partikelteori: Med øgede kollisioner og interaktioner mellem opløst stof og opløsningsmiddelpartikler bryder opløsningen fra hinanden hurtigere og spreder sig jævnt inden for opløsningsmidlet.
* Effekt på opløsning: Dette resulterer i en hurtigere opløsningshastighed. Tænk på sukkeropløsning i varm te versus kold te - sukkeret opløses meget hurtigere i den varme te, fordi vandmolekylerne bevæger sig hurtigere og interagerer med sukkermolekylerne mere effektivt.
3. Begrænsninger:
* Partikelteori: Det er vigtigt at bemærke, at selvom temperaturen generelt øger opløsningshastigheden, er der begrænsninger. Nogle stoffer, som nogle salte, bliver faktisk mindre opløselige, når temperaturen stiger. Dette skyldes komplekse kemiske interaktioner mellem det opløste stof og opløsningsmiddel, der ændrer sig med temperatur.
* opløselighed: Mens temperaturen påvirker opløsningshastigheden, påvirker den ikke altid den samlede opløselighed af et stof. Opløseligheden er den maksimale mængde opløst stof, der kan opløses i en given mængde opløsningsmiddel ved en bestemt temperatur.
I resuméet fører højere temperaturer til hurtigere opløsning, fordi:
* Mere kinetisk energi: Partikler bevæger sig hurtigere og kolliderer oftere.
* øgede interaktioner: Flere kollisioner mellem opløst stof og opløsningsmiddelpartikler resulterer i hurtigere brud på opløste bindinger og dannelse af bindinger med opløsningsmidlet.
Dette fører til en mere effektiv proces med opløsning.
Sidste artikelHvad er kraft er lig med massetid?
Næste artikelOverholder lov om elektrisk kraft tredje bevægelse?
 Varme artikler
Varme artikler
-
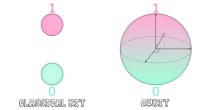 Nye computeralgoritmer udvider grænserne for en kvantefremtidQubits kan være i en superposition på 0 og 1, mens klassiske bits kun kan være det ene eller det andet. Kredit:Jerald Pinson Quantum computing lover at udnytte de mærkelige egenskaber ved kvanteme
Nye computeralgoritmer udvider grænserne for en kvantefremtidQubits kan være i en superposition på 0 og 1, mens klassiske bits kun kan være det ene eller det andet. Kredit:Jerald Pinson Quantum computing lover at udnytte de mærkelige egenskaber ved kvanteme -
 Ny biobilledteknik er hurtig og økonomiskEn ny metode hurtigt, økonomisk, og sporer nøjagtigt flere in vivo -interaktioner. Kredit:Rensselaer Polytechnic Institute En ny tilgang til optisk billeddannelse gør det muligt hurtigt og økonomi
Ny biobilledteknik er hurtig og økonomiskEn ny metode hurtigt, økonomisk, og sporer nøjagtigt flere in vivo -interaktioner. Kredit:Rensselaer Polytechnic Institute En ny tilgang til optisk billeddannelse gør det muligt hurtigt og økonomi -
 Håndtering af fejl i kvantealderenKvantekorrelationerne mellem to berylliumioner (repræsenteret som blå kugler) måles sekventielt ved hjælp af en supplerende calciumion (rød kugle) og stabiliseres ved feedbackkontrol gennem et kraftig
Håndtering af fejl i kvantealderenKvantekorrelationerne mellem to berylliumioner (repræsenteret som blå kugler) måles sekventielt ved hjælp af en supplerende calciumion (rød kugle) og stabiliseres ved feedbackkontrol gennem et kraftig -
 Kvanteforskere skaber en fejlkorrigerende katKredit:Pixabay/CC0 Public Domain Yale-fysikere har udviklet en fejlkorrigerende kat - en ny enhed, der kombinerer Schrödingers kat-begrebet superposition (et fysisk system, der eksisterer i to til
Kvanteforskere skaber en fejlkorrigerende katKredit:Pixabay/CC0 Public Domain Yale-fysikere har udviklet en fejlkorrigerende kat - en ny enhed, der kombinerer Schrödingers kat-begrebet superposition (et fysisk system, der eksisterer i to til
- Billede:Hubbles dværgstørrelse, dobbelt navngivet galakse
- Hvorfor er hanmus bange for bananer?
- Sikre stier:En tilgang til kontaktsporing, der tager udgangspunkt i privatlivets fred
- Hvordan forskning i 'ure' i planter kan ændre vores liv
- Hvad ligger ud over kanten af solsystemet?
- Bekæmpelse af Parkinsons med kulstofnanopartikler


