Hvilket volumen besættes med 1,00 kg helium ved 5,00 grader Celsius Et tryk 735 torr?
1. Konverter enheder
* masse til mol: Vi er nødt til at konvertere massen af helium (1,00 kg) til mol. Den molære masse af helium (HE) er 4,003 g/mol.
* 1,00 kg =1000 g
* mol af HE =(1000 g) / (4,003 g / mol) =249,87 mol
* Temperatur til Kelvin: Den ideelle gaslov bruger Kelvin.
* 5,00 ° C + 273,15 =278,15 K
* pres til atmosfærer:
* 735 torr * (1 atm / 760 torr) =0,967 atm
2. Ideel gaslov
Den ideelle gaslov er:PV =NRT
Hvor:
* P =pres (i ATM)
* V =volumen (i liter)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (i Kelvin)
3. Løs for volumen (v)
Omarranger den ideelle gaslov til at løse for V:
V =(nrt) / p
* V =(249,87 mol * 0,0821 L · ATM / mol · K * 278,15 K) / 0,967 atm
* V ≈ 5680 liter
Derfor besætter 1,00 kg helium ved 5,00 ° C og 735 torr ca. 5680 liter.
Sidste artikelHvad er 170 celsius i F?
Næste artikelHvor mange grader er Kelvin -11 Fahrenheit?
 Varme artikler
Varme artikler
-
 Termoelektrik:Fra varme til elektricitetKredit:Vienna University of Technology Meget varme går tabt under omdannelsen af energi. Skøn anslår det endda til mere end 70%. Men i termoelektriske materialer, som dem, der studeres ved Instit
Termoelektrik:Fra varme til elektricitetKredit:Vienna University of Technology Meget varme går tabt under omdannelsen af energi. Skøn anslår det endda til mere end 70%. Men i termoelektriske materialer, som dem, der studeres ved Instit -
 Eksperimentelt demonstreret en toffoli-port i et halvleder tre-qubit systemToffoli-porten i et tre-qubit system. Kredit:University of Science and Technology of China Et nyt fremskridt i skalering af halvleder-kvante-dot-baserede qubits er opnået for forskere ved Kinas un
Eksperimentelt demonstreret en toffoli-port i et halvleder tre-qubit systemToffoli-porten i et tre-qubit system. Kredit:University of Science and Technology of China Et nyt fremskridt i skalering af halvleder-kvante-dot-baserede qubits er opnået for forskere ved Kinas un -
 Producerer fire topkvarker på én gang for at udforske det ukendteHastighed for fire-top-kvarkproduktionen i enheder i standardmodelforudsigelsen målt ved ATLAS-eksperimentet, for de forskellige analyserede sluttilstande og deres kombination. Kredit:ATLAS Collaborat
Producerer fire topkvarker på én gang for at udforske det ukendteHastighed for fire-top-kvarkproduktionen i enheder i standardmodelforudsigelsen målt ved ATLAS-eksperimentet, for de forskellige analyserede sluttilstande og deres kombination. Kredit:ATLAS Collaborat -
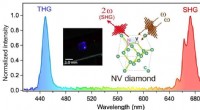 Diamantfarvecentre til ikke-lineær fotonikFigur 1. Det ikke-lineære emissionsspektrum fra diamantkrystal med NV-centre (NV-diamant) exciteret med IR-laser (1350 nm). Både SHG og THG genereres samtidigt ved 675 nm og 450 nm, henholdsvis. Et in
Diamantfarvecentre til ikke-lineær fotonikFigur 1. Det ikke-lineære emissionsspektrum fra diamantkrystal med NV-centre (NV-diamant) exciteret med IR-laser (1350 nm). Både SHG og THG genereres samtidigt ved 675 nm og 450 nm, henholdsvis. Et in
- Hurtigere detektion af fotokatalysator-genereret oxygen har store konsekvenser for ren energi
- At give briller til arbejdere i udviklingslande øger indkomsten
- Hvad er de andre subatomare partikler, der udgør magnesiumatomet udover protoner og elektroner?
- Skib, der osede olie ud for Mauritius kyst, deler sig i to
- Forskere finder potentielle våben til kampen mod antibiotikaresistens
- Hvis en simpel maskine mindsker den krævede inputkraft, gør den det af?


