Har molekylerne i en væske alle omtrent samme hastighed, eller er der en bred varity af hastigheder?
Her er hvorfor:
* kinetisk molekylær teori: Denne teori siger, at molekyler i et stof konstant er i bevægelse. Den gennemsnitlige kinetiske energi af disse molekyler er direkte proportional med temperaturen på stoffet.
* distribution af energier: Molekylerne i en væske har ikke alle den samme energi. Nogle vil bevæge sig hurtigere end andre. Denne fordeling af energier er beskrevet af maxwell-Boltzmann-distributionen .
* Kollisioner: Molekylerne i en væske kolliderer konstant med hinanden og overfører energi. Disse kollisioner får hastighederne for individuelle molekyler til at ændre sig over tid.
Nøglepunkter:
* Gennemsnitlig hastighed: Mens der er en bred vifte af hastigheder, er molekylernes gennemsnitlige hastighed relateret til væskens temperatur. Højere temperaturer betyder højere gennemsnitshastigheder.
* distribution: Formen på Maxwell-Boltzmann-distributionen fortæller os, at der er en række hastigheder, hvor den mest sandsynlige hastighed er i nærheden af gennemsnittet. Nogle molekyler bevæger sig meget langsomt, mens andre bevæger sig meget hurtigt.
Analogi: Forestil dig et overfyldt rum, hvor folk bevæger sig rundt. Nogle mennesker går langsomt, andre kører, og nogle står måske endda stille. Dette svarer til fordelingen af molekylernes hastigheder i en væske.
 Varme artikler
Varme artikler
-
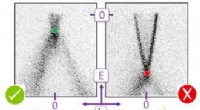 Topologiske isolatorer - et glimt er nokBåndstrukturen af en topologisk isolator målt ved hjælp af fotoemission. De mørke områder angiver, hvilke energier [på y-aksen] går sammen med hvilke (her omvendte) bølgelængder [på x-aksen] for ele
Topologiske isolatorer - et glimt er nokBåndstrukturen af en topologisk isolator målt ved hjælp af fotoemission. De mørke områder angiver, hvilke energier [på y-aksen] går sammen med hvilke (her omvendte) bølgelængder [på x-aksen] for ele -
 Fysikere opdager, hvorfor tørre flydende krystaldråber efterlader usædvanlige kafferingeEt nærbillede af tørreforløbet af Sunset Yellow. Kredit:University of Pennsylvania I tidligere aviser, University of Pennsylvania fysikere undersøgte kafferingeffekten, den ringformede plet af pa
Fysikere opdager, hvorfor tørre flydende krystaldråber efterlader usædvanlige kafferingeEt nærbillede af tørreforløbet af Sunset Yellow. Kredit:University of Pennsylvania I tidligere aviser, University of Pennsylvania fysikere undersøgte kafferingeffekten, den ringformede plet af pa -
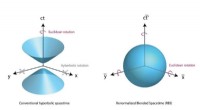 Rumtidskrystaller foreslået ved at placere rum og tid på lige fodEt diagram, der viser processen med at skabe renormaliseret blandet rumtid. Penn State videnskabsmand Venkatraman Gopalan studerer krystalstrukturer og har udviklet en ny matematisk formel, der kan lø
Rumtidskrystaller foreslået ved at placere rum og tid på lige fodEt diagram, der viser processen med at skabe renormaliseret blandet rumtid. Penn State videnskabsmand Venkatraman Gopalan studerer krystalstrukturer og har udviklet en ny matematisk formel, der kan lø -
 Hvordan isbjerge virkelig smelter - og hvad dette kan betyde for klimaændringerKredit:Aline Dassel/Pixabay Isbjerge smelter hurtigere, end de nuværende modeller beskriver, ifølge en ny undersøgelse af matematikere ved University of Sydney. Forskerne har foreslået en ny model
Hvordan isbjerge virkelig smelter - og hvad dette kan betyde for klimaændringerKredit:Aline Dassel/Pixabay Isbjerge smelter hurtigere, end de nuværende modeller beskriver, ifølge en ny undersøgelse af matematikere ved University of Sydney. Forskerne har foreslået en ny model
- Hvordan nogle væv kan 'ånde' uden ilt
- Ved at klassificere akvatiske makroinvertebrater baseret på deres bevægelse fortæller det dig om …
- Hvad er kontrasten mellem to betydninger af videnskab?
- Hvad hedder en underjordisk bjergkæde?
- Hvordan urbane lydlandskaber påvirker mennesker og dyreliv, og hvad der kan have ændret sig i stil…
- Hedebølger fra Arktis til Japan:Et tegn på ting, der skal komme?


