Hvad er trinene til kollisionsteori?
Her er de vigtigste trin, der er involveret i kollisionsteori:
1. Kollision: De reagerende molekyler skal først kollidere med hinanden. Dette er et enkelt, fysisk trin.
2. orientering: Molekylerne skal kollidere i den korrekte orientering for at reaktionen kan forekomme. Dette betyder, at de reaktive dele af molekylerne skal komme i kontakt med hinanden.
3. Aktiveringsenergi: De kolliderende molekyler skal have tilstrækkelig kinetisk energi (bevægelsesenergi) til at overvinde aktiveringsenergibarrieren. Denne energi er nødvendig for at bryde de eksisterende bindinger i reaktanterne og danne nye bindinger i produkterne.
Faktorer, der påvirker reaktionshastigheden baseret på kollisionsteori:
* Koncentration: Højere koncentration betyder flere molekyler i et givet rum, hvilket fører til hyppigere kollisioner og en hurtigere reaktionshastighed.
* Temperatur: Højere temperatur betyder, at molekyler har mere kinetisk energi, hvilket fører til flere kollisioner med tilstrækkelig energi og en hurtigere reaktionshastighed.
* overfladeareal: For reaktioner, der involverer faste stoffer, giver et større overfladeareal flere kontaktpunkter for kollisioner, hvilket øger reaktionshastigheden.
* katalysator: En katalysator giver en alternativ reaktionsvej med en lavere aktiveringsenergi, hvilket øger antallet af effektive kollisioner og fremskynder reaktionshastigheden.
nøglepunkter at huske:
* Ikke alle kollisioner resulterer i en reaktion.
* Kun kollisioner med tilstrækkelig energi og den korrekte orientering fører til vellykket produktdannelse.
* Jo højere aktiveringsenergi, jo færre vil kollisioner have nok energi til at overvinde barrieren, hvilket resulterer i en langsommere reaktionshastighed.
Kollisionsteori er et grundlæggende koncept inden for kemi og hjælper os med at forstå de faktorer, der påvirker hastigheden for en kemisk reaktion.
Sidste artikelHvad er kollisionsfrekvens?
Næste artikelEn kraft kan påvirke et objekt?
 Varme artikler
Varme artikler
-
 Lille bitte, injicerbare sensorer kunne overvåge hjerneaktivitet uden kirurgi eller implantaterKredit:Unsplash/CC0 Public Domain Forskere har udviklet nanoskala sensorer, der kan injiceres i kroppen for ikke -invasivt at spore hjerneaktivitet ved hjælp af lys. Fremgangsmåden kunne en dag ti
Lille bitte, injicerbare sensorer kunne overvåge hjerneaktivitet uden kirurgi eller implantaterKredit:Unsplash/CC0 Public Domain Forskere har udviklet nanoskala sensorer, der kan injiceres i kroppen for ikke -invasivt at spore hjerneaktivitet ved hjælp af lys. Fremgangsmåden kunne en dag ti -
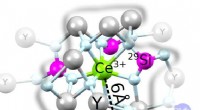 Detektering af individuelle nukleare spins med enkelte sjældne jordarters ioner hostet i krystallerSkematisk af YSO-krystallen med indlejret Ce 3+ . Inden for 6 Å afstand, 29 Si-kobling detekteres (magenta), mere fjerntliggende 29 Si kan ikke skelnes (blå). Kredit:Kornher et al. Sjældne j
Detektering af individuelle nukleare spins med enkelte sjældne jordarters ioner hostet i krystallerSkematisk af YSO-krystallen med indlejret Ce 3+ . Inden for 6 Å afstand, 29 Si-kobling detekteres (magenta), mere fjerntliggende 29 Si kan ikke skelnes (blå). Kredit:Kornher et al. Sjældne j -
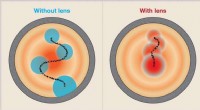 Ny type elektronlinse til næste generations kollidereEn elektronlinse introducerer forskelle i bevægelsen af partikler, der udgør en partikelbunke. I illustrationen, perspektivet kigger ned af strålerøret - ned ad partikelbunkens vej. Flokken ses som
Ny type elektronlinse til næste generations kollidereEn elektronlinse introducerer forskelle i bevægelsen af partikler, der udgør en partikelbunke. I illustrationen, perspektivet kigger ned af strålerøret - ned ad partikelbunkens vej. Flokken ses som -
 Large Hadron Collider genstarter efter tre års pauseLarge Hadron Collider har været lukket siden december 2018 for vedligeholdelse og opgraderinger. Large Hadron Collider genstartede fredag efter en tre-årig pause for opgraderinger, der vil give d
Large Hadron Collider genstarter efter tre års pauseLarge Hadron Collider har været lukket siden december 2018 for vedligeholdelse og opgraderinger. Large Hadron Collider genstartede fredag efter en tre-årig pause for opgraderinger, der vil give d
- Et omfattende kig på amerikanske standarder for brændstoføkonomi viser store besparelser på bræ…
- Sådan finder du forhistorisk Amber
- Hvilken energikilde bidrager mindst til den globale opvarmning?
- Boligprogrammer med nye aftaler øgede adskillelsen dramatisk, ny undersøgelse finder
- Hvad er der galt med denne kemiske formel CaCl2?
- Forskergruppen har lavet en fejlbestandig superlegering, der kan 3-D-printes


