Hvordan er det gennemsnitlige mængder af bevægelsesatom og molekyler et stof målt?
Sådan fungerer det:
* kinetisk energi: Bevægelsen af atomer og molekyler er direkte relateret til deres kinetiske energi. Jo hurtigere de bevæger sig, jo mere kinetisk energi besidder de.
* Temperatur: Temperaturen er et mål for den gennemsnitlige kinetiske energi af partiklerne i et stof. Jo højere temperatur, jo hurtigere bevæger partiklerne sig i gennemsnit.
* Måletemperatur: Vi bruger termometre til at måle temperaturen. Termometre fungerer ved at bruge ekspansion og sammentrækning af et stof (som kviksølv eller alkohol) som respons på temperaturændringer.
Her er nogle nøglepunkter at huske:
* absolut nul: Den temperatur, hvormed al molekylær bevægelse teoretisk stopper, kaldes absolut nul (0 Kelvin eller -273,15 grader celsius).
* forskellige temperaturskalaer: Der findes forskellige temperaturskalaer (Celsius, Fahrenheit, Kelvin), men de afspejler alle det samme grundlæggende begreb om gennemsnitlig kinetisk energi.
* Stater af stof: Temperaturen på et stof påvirker dens stofstilstand (fast, flydende, gas). Højere temperaturer svarer generelt til mere energiske partikler og en mindre kondenseret tilstand.
Det er vigtigt at bemærke: Temperatur afspejler kun den * gennemsnitlige * kinetiske energi. Individuelle molekyler i et stof vil have en række kinetiske energier, men temperaturen giver en repræsentativ foranstaltning.
Sidste artikelHvordan finder du accelerationen uden at kende kraft?
Næste artikelHvordan definerer forskere acceleration?
 Varme artikler
Varme artikler
-
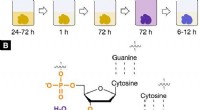 Nucleus-specifik røntgenfarvning til 3-D virtuel histologiRøntgen egnet, kernespecifik farvningsmiddelprotokol til 3D virtuel histologi. Farvningsprotokol og interaktion af den hæmatein-baserede røntgenfarvning med blødt væv. (A) Den udviklede hæmatein-baser
Nucleus-specifik røntgenfarvning til 3-D virtuel histologiRøntgen egnet, kernespecifik farvningsmiddelprotokol til 3D virtuel histologi. Farvningsprotokol og interaktion af den hæmatein-baserede røntgenfarvning med blødt væv. (A) Den udviklede hæmatein-baser -
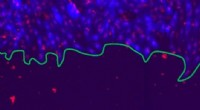 Et fysikperspektiv på sårhelingFluorescerende mikroskopibillede af en prolifererende cellefront, hvis kant er markeret med grønt. Rotteepitelcellerne, med cytoplasma (blå) og kerner (rød), danne en 2-dimensionel kultur, som kan bru
Et fysikperspektiv på sårhelingFluorescerende mikroskopibillede af en prolifererende cellefront, hvis kant er markeret med grønt. Rotteepitelcellerne, med cytoplasma (blå) og kerner (rød), danne en 2-dimensionel kultur, som kan bru -
 Hvordan en partikel kan stå stille i roterende rumtidNår en partikel med et bestemt vinkelmoment er placeret i den kritiske afstand først, den forbliver i ro, mens rumtiden roterer rundt om den. Jo tættere en partikel er på denne kritiske afstand, jo la
Hvordan en partikel kan stå stille i roterende rumtidNår en partikel med et bestemt vinkelmoment er placeret i den kritiske afstand først, den forbliver i ro, mens rumtiden roterer rundt om den. Jo tættere en partikel er på denne kritiske afstand, jo la -
 Fysikere skaber ny klasse af 2-D kunstige materialerAtomernes positioner i et ferroelektrisk metal, der indeholder bariumtitanat, strontiumtitanat og lanthantitanat. Kredit:Zhen Wang og Yimei Zhu; billede opnået på Brookhaven National Laboratory I
Fysikere skaber ny klasse af 2-D kunstige materialerAtomernes positioner i et ferroelektrisk metal, der indeholder bariumtitanat, strontiumtitanat og lanthantitanat. Kredit:Zhen Wang og Yimei Zhu; billede opnået på Brookhaven National Laboratory I
- Hvilken slags energi bruges, når man kører på en skolebus?
- Hvilken kraft får genstande til at falde til jorden?
- Hvad er egenskaber ved livet, der demonstrerede i cellulær respiration?
- Hvad er det matematiske forhold mellem tyngdekraften FG Magnetic FM og elektrostatisk F?
- Hvad forventes formlen for ionisk forbindelse at dannes mellem elementer BA og O?
- Facebook vil tackle bestræbelserne på at blande sig i 2020-amerikansk folketælling


