Nucleus-specifik røntgenfarvning til 3-D virtuel histologi
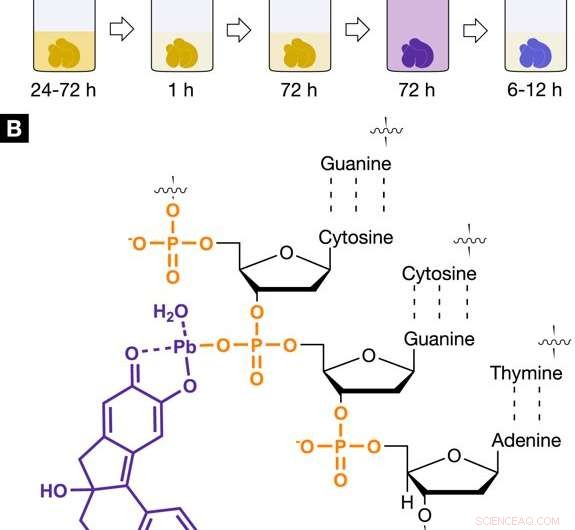
Røntgen egnet, kernespecifik farvningsmiddelprotokol til 3D virtuel histologi. Farvningsprotokol og interaktion af den hæmatein-baserede røntgenfarvning med blødt væv. (A) Den udviklede hæmatein-baserede farvningsprocedure viser de individuelle involverede trin, herunder inkubations- og farvningstider. Farvningstrin 1 blev udført under anvendelse af bly(II)acetattrihydrat som tungmetalkilden. Bly(II)acetattrihydratet blev opløst i destilleret vand og omtales som arbejdsopløsning (A) (WS (A)). Farvningstrin 2 involverede en hæmateinopløsning i absolut ethanol (WS (B), 10 % (vægt/volumen); c = 333 mM), som var afledt af hæmatoxylin og blev tilsat til WS (A). (B) Det positivt ladede hæmatein bly(II) kompleks (lilla), som er indbygget in situ i bløddelsprøven, interagerer med den negativt ladede fosfatrygrad i DNA'et (orange), der er til stede i cellens kerne. Den selektive interaktion af hæmatein bly(II) komplekset med DNA'et opnås ved forsuring af det bløde væv under fiksering eller før farvning og muliggør en højere akkumulering af hæmatein bly(II) komplekset i cellekernen. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y
Histologi bruges til at identificere strukturelle detaljer i væv i mikroskala i patologilaboratoriet, men analyser forbliver todimensionelle (2D), da de er begrænset til det samme plan. Ikke-destruktive 3D-teknologier inklusive røntgenmikro- og nanocomputertomografi (nanoCT) har bevist validitet til at forstå anatomiske strukturer, da de tillader vilkårlige betragtningsvinkler og 3D strukturelle detaljer. Imidlertid, lav dæmpning af blødt væv har hæmmet deres anvendelse inden for 3D virtuel histologi. I en nylig undersøgelse, nu offentliggjort den Videnskabelige rapporter , Mark Müller og kolleger ved Institut for Fysik og Bioteknik har udviklet en hæmatein-baseret røntgenfarvningsmetode til specifikt at målrette cellekerner, efterfulgt af demonstrationer på en hel leverlapp af en mus.
Den nye farvningsprotokol kombinerede den nyligt udviklede, højopløsnings nanoCT-system til 3D-visualisering af vævsarkitekturen på nanometerskalaen. Resultaterne afslørede den virkelige 3D-morfologi sammen med rumlig fordeling af cellekerner. Teknikken var også kompatibel med konventionel histologi, da mikroskopiske objektglas med bløddelsprøve kunne farves med den samme protokol sammen med yderligere modfarvning. Metoden demonstrerede muligheden for fremtidige anvendelser inden for histopatologi ledsaget af røntgen-CT-apparater i laboratoriet.
Histologi er den eksisterende guldstandard for en nøjagtig mikroanatomisk diagnose i patologilaboratoriet, teknikker og resultater er dog begrænset til 2D. For eksempel, en 3D-biopsi undersøges normalt ved hjælp af meget tynde mikroskopiske objektglas (indeholdende 2-10 µm tykke skiver) via konventionelle og moderne immunhistokemiske og histologiske farvningsteknikker. Mikro- og nano-CT er kraftfulde værktøjer, der kan give en nøjagtig rekonstruktion af væv i 3D. Udviklingen af teknologien har muliggjort en forholdsvis høj opløsning i forhold til eksisterende 2D konventionel histologi, ved hjælp af enheder lige fra store partikelacceleratorer til laboratoriebaserede røntgenapparater.
Ud over de tekniske krav, Røntgenegnede farvningsmidler (kontrastmidler) såsom fotowolframsyre (PTA), jod kaliumiodid (IKI), jod i ethanol (12E), eller jod i methanol (12M) er også vigtige. De tilgængelige farvningsmidler er dog, i øjeblikket begrænset i omfang og effektivitet. Ved udvikling af næste generations medicinske diagnostik inden for histopatologi, forskere sigter mod at optimere teknikkerne og forstå vævsarkitektur fra celleniveau til vævsskala.
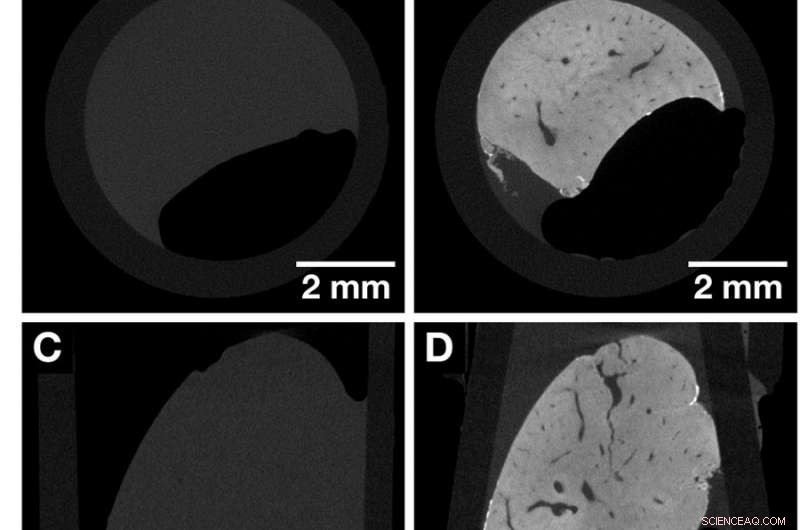
CT-skiver af den samme hele museleverlapp før og efter farvning, der fremhæver kontrastforøgelsen opnået efter påføring af den hæmateinbaserede røntgenfarvning. Begge datasæt blev erhvervet med Xradia Versa 500 microCT ved hjælp af identiske optagelsesparametre. Voxelstørrelsen i begge datasæt er 13,5 µm. (EN, C og E) Oversigtsbilleder af den ufarvede museleverlapp, der repræsenterer udsigterne langs de kartesiske akser. (B, D og F) Oversigtsbilleder af den samme museleverlobuleprøve i (A, C og E) efter farvning, der repræsenterer udsigterne langs de kartesiske akser. Anatomiske strukturer såsom vaskulaturen visualiseres. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
Under den første diagnose i klinisk patologi, cellekernerne og cytoplasmaet er af betydning. Næsten hver histologisk prøve er derfor ofte farvet via standard hæmatoxylin og eosin (H&E) protokol for at identificere kernerne og cytoplasmaet. Men standarder for hæmatoxylinfarvningen er ikke faste, og mange varianter af protokollen eksisterer på grund af forskellige vævstyper og/eller forbehandlingsparametre involveret. Som resultat, Müller et al. introducerede en hæmatein-baseret farvningsprotokol, specielt udviklet til CT, for at muliggøre direkte 3D-visualisering af cellekerner i blødt vævsprøver. Det kraftfulde potentiale af microCT eller nanoCT kombineret med røntgenegnede farvninger vil tillade fremtidig indsigt i vævsorganisation for at forstå sygdom, herunder slidgigt og kræft, ved den cellulære nanoarkitektur.
Ved udvikling af den nye røntgenstråle, hæmatein-baseret farvning, den almindeligt anvendte Mayers hæmatoxylin og Wiegerts jernhæmatoxylin var inkluderet i dens konstitution. Farvningseksperimenterne blev udført på væv fra museleverlobuli, bruges til røntgen-CT-billeddannelse derefter. Den optimerede farvningsprotokol indeholdt fem trin, der startede med kontrolleret syrning af bløddelsprøver under fiksering. Det bløde væv blev fremstillet på molekylært niveau for at farve med hæmatein bly (II) komplekset.
I sin virkningsmekanisme, forskerne viste en styrket ionisk interaktion mellem det positivt ladede hæmatein bly (II) kompleks og den negativt ladede fosfatrygrad i deoxyribonukleinsyren (DNA). Den kemiske reaktion sikrede højere akkumulering af farvningsmidlet i cellekernerne ved at danne et hæmatein bly (II) DNA-kompleks, som et røntgen-egnet middel.

NanoCT-data (A-C) sammenlignet med det histologiske mikroskopiske objektglas (D) afledt af den samme museleverlobule efter anvendelse af den hæmateinbaserede røntgenfarvningsprotokol. Klar visualisering af de større hepatocytcellekerner og de mindre cellekerner såsom Kupffer-celler og SEC'er i hvid (A-C) eller mørk lilla (D) og BC-netværket vist i sort (A-C) eller hvid (D) blev opnået, henholdsvis. (A) Volumen af interesse (VOI), der fremhæver de to nanoCT-skiver vist i (B, blå ramme) og (C, orange ramme). (B, C) Repræsentative individuelle nanoCT-skiver som angivet i VOI fra (A). (B) og (C) er placeret ortogonalt i forhold til hinanden. Orienteringen af BC-netværket, som dannes af hepatocytterne ses, dvs. mere vandret arrangement ses i (B) og en mere lodret justering i (C). NanoCT skivetykkelsen er 580 nm. (D) Repræsentativt histologisk mikroskopisk objektglas med en tykkelse på 3 µm opnået fra den samme museleverlobuleprøve efter påføring af den hæmateinbaserede farve og indlejring af den i en paraffinblok. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
For at sammenligne farvningseffektiviteten, museleverlobuvævet blev afbildet med microCT før farvning, efterfulgt af billeddannelse efter hæmatein-protokol baseret farvning. Farvningsprocessen foregik i to trin, og den ønskede kontrastforøgelse blev opnået som forventet efter farvning. Resultaterne blev observeret ved hjælp af microCT-oversigten til at vise distinkte anatomiske strukturer, herunder vaskulaturen. Farvningen var homogen i hele museleverlappen, i modsætning til tidligere eksempler i store levervævsprøver. 3D-billeddannelsesprocessen tillod adgang til en række CT-skiver i vilkårlige planer. Desuden, i modsætning til konventionel 2D histologi (med paraffinindlejret blødt væv), det bløde væv kunne ses fra forskellige vinkler.
Vævet blev derefter undersøgt på subcellulært niveau med mindre stykker af den samme leverlobuli, som blev dissekeret og analyseret ved hjælp af nanoCT. De visualiserede resultater viste områder af interessevolumen (VOI), cellekerner af hepatocytterne og kerner af andre celletyper (Kupffer-celler og sinusformede endotelceller). Sorte hele strukturer repræsenterede galdekanalnetværket (BC), mens de mørkere grå værdier indikerede cytoplasmaet af levervævsprøven. Orienteringen af BC-netværket blev også observeret. Vævet blev derefter undersøgt med konventionel histologi, ved at bruge meget tynde mikroskopiske objektglas uden anden farvning ud over den påførte hæmateinbaserede farve. Den konventionelle teknik bekræftede ligeledes morfologien af hepatocytter og andre celletyper (kerner farvet i mørk lilla), mens BC-netværket var farvet i hvidt.
3D-kerner og analyse af forskellige cellekerner til stede i muselevervolumenet af interesse (VOI). Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
Forskerne har sammenlignet bekræftet 3D-data rekonstruktionsnøjagtighed i undersøgelsen med tidligere undersøgelser. Når den hæmatein-baserede procedure blev genanvendt i konventionelle 2D histologiske undersøgelser, forskerne anvendte også en standard modfarvning, eosin Y specifik, til cellens cytoplasma videre til vævet. I resultaterne, cellekernerne forblev lilla, mens cytoplasmaet optog den lyserøde plet. På denne måde forskerne autentificerede den kernespecifikke hæmatein-baserede farvningskapacitet også med standard histologi.
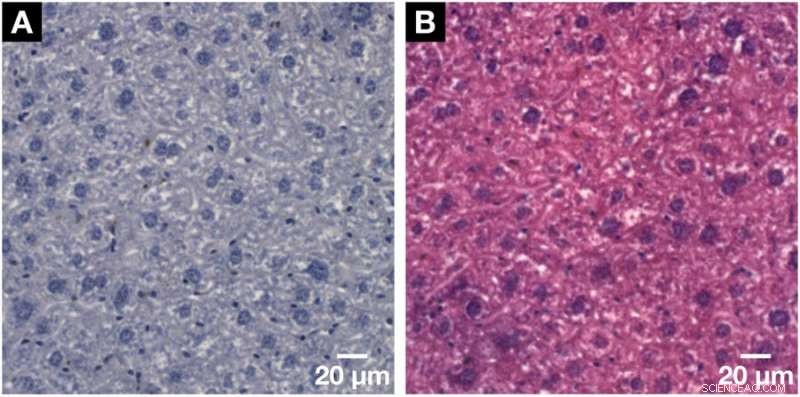
Demonstration af den histologiske kompatibilitet af den for røntgenmikroCT og nanoCT udviklede hæmateinbaserede farvningsmetode med konventionel 2D histologi. (A) Repræsentativt histologisk mikroskopisk objektglas med en tykkelse på 3 µm opnået fra den samme museleverlobuleprøve efter den påførte hæmateinbaserede farvning og indlejring i en paraffinblok. Klar visualisering af de større hepatocytcellekerner og de mindre cellekerner såsom Kupffer-celler og SEC'er i mørk lilla og BC-netværket vist i hvidt. (B) Kompatibiliteten med standard modfarven af eosin Y blev vist på et efterfølgende mikroskopisk objektglas set i (A). Cellekernerne er vist i lilla ved siden af cytoplasmaet i pink, hvilket resulterer i et typisk H&E-farvet mikroskopisk objektglas af en blødt vævsprøve. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
Den hæmatein-baserede farvningsprotokol hjalp højopløsnings CT-visualisering af cellekerner i blødt væv i sub-mikronområdet, hidtil ikke muligt med andre farvningsmetoder, der var kombineret med microCT-teknologi. Fremtidige histopatologiske undersøgelser kan muligvis eliminere tidskrævende forberedelsesprocedurer og tab af vævsprøver (som set med standard histologi) for at opnå individuelle vævsskiver via 3D-undersøgelse af en hel VOI, som vist i nærværende undersøgelse. Evnen til at screene en større prøve for unormale cellekerner kunne hjælpe patologer med at identificere områder med inflammation for at vurdere sygdomsætiologi og progression.
Farvningsprotokollen er enkel og reproducerbar, velegnet til CT-farvning af hele organer, kombineret med 3D-visualisering og dybdegående, ikke-destruktiv analyse af bløddelsprøver. Farvningsmidlerne anført i protokollen er let tilgængelige, mens den kombinerede CT-røntgenprotokol tillader større sofistikering af bløddelsprøveanalyser. Trin i farvningsprotokollen vil kræve yderligere optimering med forskellige vævstyper og i forskellige applikationer, inklusive 3D histologi, udviklings- og strukturbiologiske studier i laboratoriet.
© 2018 Science X Network
 Varme artikler
Varme artikler
-
 Forskellen mellem optisk densitet og absorbansOptiske enheder spiller en vigtig rolle i en lang række moderne teknologier. De findes i CD-, DVD- og Blu-Ray-afspillere, fiberoptiske kabelbokse og optiske komponenter. De har endda anvendelser i vis
Forskellen mellem optisk densitet og absorbansOptiske enheder spiller en vigtig rolle i en lang række moderne teknologier. De findes i CD-, DVD- og Blu-Ray-afspillere, fiberoptiske kabelbokse og optiske komponenter. De har endda anvendelser i vis -
 En ny teknik gør det muligt for forskere at oprette rigtige systemkartografiske kort i forskellige …At kunne bevæge sig rundt i et netværk i flere skalaer er meget vigtigt i systemer, hvor du har mange interagerende elementer. Kredit:M. Serrano Forskere ved Institute of Complex Systems ved Unive
En ny teknik gør det muligt for forskere at oprette rigtige systemkartografiske kort i forskellige …At kunne bevæge sig rundt i et netværk i flere skalaer er meget vigtigt i systemer, hvor du har mange interagerende elementer. Kredit:M. Serrano Forskere ved Institute of Complex Systems ved Unive -
 Fluorescensmikroskopi får BAMM -behandlingenDr Antony Orth. Kredit:CNBP-RMIT En ny teknik udviklet af forskere ved ARC Center of Excellence for Nanoscale BioPhotonics (CNBP) vil hjælpe med at skinne nyt lys på biologiske spørgsmål ved at fo
Fluorescensmikroskopi får BAMM -behandlingenDr Antony Orth. Kredit:CNBP-RMIT En ny teknik udviklet af forskere ved ARC Center of Excellence for Nanoscale BioPhotonics (CNBP) vil hjælpe med at skinne nyt lys på biologiske spørgsmål ved at fo -
 Sådan konverteres tommer til kubisk fødeDen kubiske fod er en ikke-metrisk enhed til måling af lydstyrken. Definitionen på en kubikfod er lydstyrken på en terning med sider, der måler 1 lineær fod. Når du foretager den matematiske konver
Sådan konverteres tommer til kubisk fødeDen kubiske fod er en ikke-metrisk enhed til måling af lydstyrken. Definitionen på en kubikfod er lydstyrken på en terning med sider, der måler 1 lineær fod. Når du foretager den matematiske konver
- Eurozonens banker foreslår europæisk betalingssystem for at konkurrere med Visa, Mastercard
- Hvordan dit sociale netværk kan redde dig fra en naturkatastrofe
- Open source-system, der sikrer softwareopdateringer, der er uddannet for at beskytte førende cloud-…
- Casio Calculator FX-82MS instruktioner
- Tegnsætning i tekstbeskeder hjælper med at erstatte stikord, der findes i ansigt-til-ansigt-samtal…
- Gletsjere og gådefulde stenstriber i det etiopiske højland


