Hvilke enheder bruger forskere for at måle masse af atomer deres subatomære partikler?
* atomer er utroligt små: Massen af individuelle atomer og subatomære partikler er utroligt lille. Brug af standardenheder som gram eller kg ville resultere i ekstremt små og besværlige tal.
* relativ masse er nøglen: Det er vigtigere at kende relative masse af et atom sammenlignet med et andet. For eksempel er det at vide, at kulstof er 12 gange tungere end brint, mere nyttigt end at kende den nøjagtige masse i gram.
Hvad er en atommasseenhed (AMU)?
* Definition: En atommasseenhed (AMU) er defineret som 1/12 massen af et carbon-12-atom.
* Praktisk værdi: Denne definition giver mulighed for en enkel og konsekvent måde at sammenligne masserne af forskellige atomer.
* anden enhed: Du kan også se enheden dalton (DA) brugt, som svarer til atommasseenheden (AMU).
Vigtige noter:
* Protoner og neutroner: Protoner og neutroner har omtrent den samme masse, hver omtrent 1 amu.
* Elektroner: Elektroner er meget lettere med en masse på ca. 1/1836 amu.
Fortæl mig, hvis du gerne vil udforske nogen af disse koncepter mere detaljeret!
Sidste artikelHvordan definerer forskere udtrykket kraft?
Næste artikelHvad bruger forskere til at måle massen af partikler i et atom?
 Varme artikler
Varme artikler
-
 Helt optiske diffraktive neurale netværk behandler bredbåndslysPrototype af et bredbåndsdiffraktivt dybt neuralt netværk. Kredit:Ozcan Lab @ UCLA Diffraktivt dybt neuralt netværk er en optisk maskinlæringsramme, der blander dyb læring med optisk diffraktion o
Helt optiske diffraktive neurale netværk behandler bredbåndslysPrototype af et bredbåndsdiffraktivt dybt neuralt netværk. Kredit:Ozcan Lab @ UCLA Diffraktivt dybt neuralt netværk er en optisk maskinlæringsramme, der blander dyb læring med optisk diffraktion o -
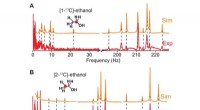 Mindre risiko, færre omkostninger:Bærbare spektroskopi-enheder kan snart blive virkeligeSimulerede og eksperimentelle nulfelt J-spektre (64 scanninger) af [1-13 C]-ethanol og [2-13 C]-ethanol (230 mM) hyperpolariseret af SABRE-Relay separat under anvendelse af bæreraminen benzylamin. Rød
Mindre risiko, færre omkostninger:Bærbare spektroskopi-enheder kan snart blive virkeligeSimulerede og eksperimentelle nulfelt J-spektre (64 scanninger) af [1-13 C]-ethanol og [2-13 C]-ethanol (230 mM) hyperpolariseret af SABRE-Relay separat under anvendelse af bæreraminen benzylamin. Rød -
 Probe til nanofibre har følsomhed i atomskalaGrafisk, der viser nanofiber -flygtigt lys (rødt), der kommer ind i sondefiber (større glascylinder). Kredit:E. Edwards Optiske fibre er rygraden i moderne kommunikation, kører information fra A t
Probe til nanofibre har følsomhed i atomskalaGrafisk, der viser nanofiber -flygtigt lys (rødt), der kommer ind i sondefiber (større glascylinder). Kredit:E. Edwards Optiske fibre er rygraden i moderne kommunikation, kører information fra A t -
 Sætter et nyt spin på Majorana fermionerTeoretiske beregninger udført af (venstre til højre) Neil Robinson, Robert Konik, Alexei Tsvelik, og Andreas Weichselbaum fra Brookhaven Labs afdeling for kondenseret materie i fysik og materialer vid
Sætter et nyt spin på Majorana fermionerTeoretiske beregninger udført af (venstre til højre) Neil Robinson, Robert Konik, Alexei Tsvelik, og Andreas Weichselbaum fra Brookhaven Labs afdeling for kondenseret materie i fysik og materialer vid
- Hvad ville være accelerationen af en krop, hvis dens hastighedstid graf er linje parallelt med ak…
- Forskere bruger almindeligt glas til at optimere grafenernes elektroniske egenskaber
- Ingeniører opdager, at visualisering af, hvor dårlig luftkvaliteten er i dit hjem, kan hjælpe med…
- Hvor var tsunamien i Det Indiske Ocean?
- Matematiker og astronom, der foretog nøjagtige målinger af tusinder stjernernes afstande?
- Omdannelse af gas til brændstoffer med bedre legeringer


