Hvordan forklarer teorien, hvorfor faste stoffer holder deres former?
kmt og faste stoffer:
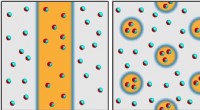
* Stærke intermolekylære kræfter: Partiklerne (atomer, ioner eller molekyler) i et fast stof holdes sammen af stærke attraktive kræfter (som ioniske bindinger, kovalente bindinger eller metalliske bindinger). Disse kræfter er meget stærkere end i væsker eller gasser.
* faste positioner: På grund af de stærke kræfter, partikler i en solid vibrer i faste positioner. De har ikke friheden til at bevæge sig som partikler i væsker eller gasser.
* Luk pakning: Partiklerne i et fast stof er tæt pakket sammen, hvilket efterlader lidt tomt rum mellem dem.
Hvorfor forklarer dette solid form:
* stivhed: De stærke kræfter og faste positioner af partikler giver faste stoffer deres stivhed. De modstår deformation og opretholder deres form.
* inkomprimerbarhed: Fordi partiklerne er tæt pakket, er faste stoffer næsten ukomprimerbare. Du kan ikke nemt skubbe dem ind i et mindre volumen.
* bestemt bind: Partiklernes faste positioner fører til et bestemt volumen for et fast stof. Det ændrer sig ikke meget, selvom du lægger pres.
Eksempel:
Forestil dig en isblok. Vandmolekylerne i isen er låst i en krystallinsk struktur. De vibrerer på plads, men de bevæger sig ikke frit. Denne struktur giver isen sin solide form. Hvis du prøver at komprimere isen, finder du det meget vanskeligt at gøre det, fordi molekylerne allerede er pakket tæt.
Vigtig note:
Mens faste stoffer generelt er stive, kan de deformeres under visse betingelser, såsom højt tryk eller ekstrem temperatur. Dette skyldes, at de stærke kræfter, der holder partiklerne sammen, kan overvindes.
Sammenfattende forklarer KMT, at de stærke intermolekylære kræfter, faste positioner og tæt pakning af partikler i faste stoffer er ansvarlige for deres stive, ukomprimerbare og konkrete form.
Sidste artikelHvad er en udøvelse?
Næste artikelBølger, i hvilket materie mediet bevæger sig den samme bølgeretning?
 Varme artikler
Varme artikler
-
 Er glasovergangen drevet af termodynamik?Glasovergang drevet af termodynamik. Kredit:Hajime Tanaka Glassige stoffer er overalt, alligevel er denne tilstandstilstand ikke fuldstændig forstået. Det grundlæggende billede er klart nok - glas
Er glasovergangen drevet af termodynamik?Glasovergang drevet af termodynamik. Kredit:Hajime Tanaka Glassige stoffer er overalt, alligevel er denne tilstandstilstand ikke fuldstændig forstået. Det grundlæggende billede er klart nok - glas -
 Et prikket mønster vises i superfluid helium-3 i en tynd celle, når den udsættes for et magnetfel…(Venstre) En skitse af den endimensionelle ordre-parameter modulering i FFLO tilstand af organiske superledere, hvor striberne svarer til forskellige superledende faser adskilt af magnetisk ordnede om
Et prikket mønster vises i superfluid helium-3 i en tynd celle, når den udsættes for et magnetfel…(Venstre) En skitse af den endimensionelle ordre-parameter modulering i FFLO tilstand af organiske superledere, hvor striberne svarer til forskellige superledende faser adskilt af magnetisk ordnede om -
 Exciton resonans tuning af en atomisk tynd linseAtomisk tynde og justerbare flade linser. en, Skematisk af den foreslåede WS2-zonepladelinse i en elektrokemisk celle. Tidsvarierende ionisk-væske-gatespændinger resulterer i en modulering af fokuseri
Exciton resonans tuning af en atomisk tynd linseAtomisk tynde og justerbare flade linser. en, Skematisk af den foreslåede WS2-zonepladelinse i en elektrokemisk celle. Tidsvarierende ionisk-væske-gatespændinger resulterer i en modulering af fokuseri -
 Ny printer skaber ekstremt realistiske farverige hologrammerDen nye printer bruger kontinuerlige bølgelasere med lav effekt til at skabe hologrammer på et meget følsomt fotomateriale udviklet af forskerne. Kredit:C Yves GENTET Forskere har udviklet en ny p
Ny printer skaber ekstremt realistiske farverige hologrammerDen nye printer bruger kontinuerlige bølgelasere med lav effekt til at skabe hologrammer på et meget følsomt fotomateriale udviklet af forskerne. Kredit:C Yves GENTET Forskere har udviklet en ny p
- Sådan fungerer flydende broer
- Hvordan starter Apollo fra overfladen?
- Er et batteribilseksempel på termisk energi?
- Hvad er de ændringer, der forekommer i Wave Energy ved udlandet?
- Et interessant indblik i, hvordan fremtidens state-of-the-art elektronik kan fungere
- Californien er berømt for jordskælv og skovbrande - men glem ikke dets vulkaner


