Hvad er bevægelsen af partikler inden for væsker?
* Konstant bevægelse: I modsætning til faste stoffer, hvor partikler er fastgjort på plads, bevæger flydende partikler konstant. Denne bevægelse drives af den termiske energi, de besidder.
* Tilfældig bevægelse: Bevægelsesretningen er uforudsigelig og ændres ofte på grund af kollisioner med andre partikler.
* Begrænset rækkevidde: I modsætning til gasser, hvor partikler kan bevæge sig frit, holdes flydende partikler sammen af relativt stærke intermolekylære kræfter. Dette begrænser den afstand og hastighed, hvorpå de kan bevæge sig.
Her er en visuel analogi:
Forestil dig et overfyldt dansegulv. Mennesker (flydende partikler) støder konstant på hinanden og bevæger sig rundt, men ikke med fuldstændig frihed. De kan ikke bevæge sig meget langt fra deres umiddelbare naboer på grund af mængden. Dette svarer til, hvordan flydende partikler er begrænset af deres intermolekylære kræfter.
Nøgleforskelle fra faste stoffer og gasser:
* faste stoffer: Partikler er tæt pakket og vibrerer på plads.
* Gasser: Partikler bevæger sig frit og har en meget større afstand mellem dem.
Denne konstante og tilfældige bevægelse af partikler i væsker er ansvarlig for flere vigtige egenskaber, herunder:
* Fluiditet: Væsker kan flyde og tage formen på deres beholder.
* diffusion: Væsker kan blandes med hinanden over tid.
* Termisk ledningsevne: Væsker kan overføre varme.
At forstå bevægelsen af partikler inden for væsker er afgørende for at forstå opførsel og egenskaber ved forskellige materialer og processer.
Sidste artikelHvilken kraft sprænger en ballon?
Næste artikelHvilken er korteste frekvens 10MHz 100MHz 1GHz 100 GHz?
 Varme artikler
Varme artikler
-
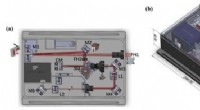 Bredt spektralområde få-cyklus laserpulser karakterisering ved hjælp af en FASI-enhedFig. 1. layout af FASI -enheden. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har udviklet en simpel enhed kaldet frekv
Bredt spektralområde få-cyklus laserpulser karakterisering ved hjælp af en FASI-enhedFig. 1. layout af FASI -enheden. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har udviklet en simpel enhed kaldet frekv -
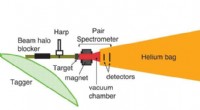 Forbedret forsøg af Primakoff-typen giver forbedret nøjagtighed af pionmålingForsøgsopstilling. Skematisk visning af PrimEx-II eksperimentelle opsætning (ikke i skala; se teksten for en beskrivelse af individuelle detektorer og komponenter). Kredit: Videnskab (2020). DOI:10.1
Forbedret forsøg af Primakoff-typen giver forbedret nøjagtighed af pionmålingForsøgsopstilling. Skematisk visning af PrimEx-II eksperimentelle opsætning (ikke i skala; se teksten for en beskrivelse af individuelle detektorer og komponenter). Kredit: Videnskab (2020). DOI:10.1 -
 Nanoskala analyse af materialer til fremtidige fusionsreaktorerKredit:National Research Nuclear University Forskere fra National Research Nuclear University MEPhI (Rusland) har afklaret, hvordan ændring af nanostrukturen af materialer til fremtidige energif
Nanoskala analyse af materialer til fremtidige fusionsreaktorerKredit:National Research Nuclear University Forskere fra National Research Nuclear University MEPhI (Rusland) har afklaret, hvordan ændring af nanostrukturen af materialer til fremtidige energif -
 Elektronmikroskopdetektor opnår rekordopløsningEt ptykografisk billede af to ark molybdendisulfid, med den ene roteret med 6,8 grader i forhold til den anden. Afstandene mellem individuelle atomer spænder fra en fuld atombindingslængde ned til f
Elektronmikroskopdetektor opnår rekordopløsningEt ptykografisk billede af to ark molybdendisulfid, med den ene roteret med 6,8 grader i forhold til den anden. Afstandene mellem individuelle atomer spænder fra en fuld atombindingslængde ned til f
- De radioaktive emissioner, der ikke har nogen elektrisk ladning, er?
- Den menneskelige robot Pepper er morsom, men praktisk?
- Det mest detaljerede radiokort over Mælkevejen
- Astronomer studerer disse for at lære egenskaber hos stjerner?
- Udforskning af dybderne:Hvordan jernsne kunne låse op for livets hemmeligheder på Europa
- Hvordan kan en baby lære to sprog på samme tid?


