Hvordan bevæger partikler sig ved højere temperaturer sammenlignet med hvordan de sænker temperaturer?
Højere temperaturer:
* hurtigere bevægelse: Partikler ved højere temperaturer bevæger sig hurtigere. Tænk på det som at opvarme en gryde med vand - molekylerne bevæger sig mere kraftigt, hvilket får vandet til at boble og udvide.
* Større kinetisk energi: Denne hurtigere bevægelse oversættes til større kinetisk energi. Kinetisk energi er bevægelsesenergien.
* Flere kollisioner: Når partikler bevæger sig hurtigere, kolliderer de med hinanden hyppigere og med større kraft.
* Øget afstand: De øgede energi og kollisioner får partiklerne til at sprede sig yderligere, hvilket resulterer i ekspansion (som vandet i gryden).
Nedre temperaturer:
* langsommere bevægelse: Partikler ved lavere temperaturer bevæger sig langsommere. Tænk på et koldt glas vand - molekylerne bevæger sig mere træg.
* Nedre kinetisk energi: Langsomere bevægelse betyder lavere kinetisk energi.
* færre kollisioner: Partikler kolliderer sjældnere og med mindre kraft.
* reduceret afstand: Med mindre energi sætter partikler sig tættere sammen, hvilket resulterer i sammentrækning (som vandet i glasset krymper lidt, når det bliver koldere).
Vigtigheden af temperatur:
Temperaturen er et mål for den gennemsnitlige kinetiske energi af partiklerne i et stof. Jo varmere stoffet er, jo mere er dets partikler rundt omkring, og jo mere energi besidder de.
Key Takeaway: Temperatur påvirker direkte hastigheden og energien fra partikler, hvilket fører til ændringer i deres bevægelse og afstand.
 Varme artikler
Varme artikler
-
 Ser stabil topologi ved hjælp af ustabilitetFigur 1. Den rumlige intensitetsprofil for en laserstråle, der formerer sig i et ikke -lineært medium, bliver spontant ikke -ensartet på grund af processen med modulerende ustabilitet. Kredit:Institut
Ser stabil topologi ved hjælp af ustabilitetFigur 1. Den rumlige intensitetsprofil for en laserstråle, der formerer sig i et ikke -lineært medium, bliver spontant ikke -ensartet på grund af processen med modulerende ustabilitet. Kredit:Institut -
 Spændende tegn på faseskiftsturbulens i RHIC-kollisionerSTAR-detektoren ved det amerikanske energiministeriums Brookhaven National Laboratory Kredit:Brookhaven National Laboratory Fysikere studerer kollisioner af guldioner ved Relativistic Heavy Ion Co
Spændende tegn på faseskiftsturbulens i RHIC-kollisionerSTAR-detektoren ved det amerikanske energiministeriums Brookhaven National Laboratory Kredit:Brookhaven National Laboratory Fysikere studerer kollisioner af guldioner ved Relativistic Heavy Ion Co -
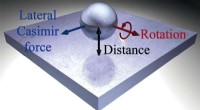 Fysikeren opdager mærkelige kræfter, der virker på nanopartiklerKredit:University of New Mexico Et nyt videnskabeligt papir udgivet, delvis, af et universitet i New Mexico kaster fysiker lys over en mærkelig kraft, der påvirker partikler på det mindste niveau
Fysikeren opdager mærkelige kræfter, der virker på nanopartiklerKredit:University of New Mexico Et nyt videnskabeligt papir udgivet, delvis, af et universitet i New Mexico kaster fysiker lys over en mærkelig kraft, der påvirker partikler på det mindste niveau -
 Krøllet Mylar fandt at huske, hvor længe den var krøllet(a) Et netværk af folder, der pynter ansigtet på en udfoldet, krøllet bold af Mylar. Indsats:en krøllet Mylar -bold. (b) Stress afslapning af den krøllede Mylar kugle. Kredit:arXiv:1608.02429 [cond-ma
Krøllet Mylar fandt at huske, hvor længe den var krøllet(a) Et netværk af folder, der pynter ansigtet på en udfoldet, krøllet bold af Mylar. Indsats:en krøllet Mylar -bold. (b) Stress afslapning af den krøllede Mylar kugle. Kredit:arXiv:1608.02429 [cond-ma
- Hvad er tætheden af et rektangel?
- Undersøgelse viser afsaltning med nanoporøs grafenmembran
- Hvordan tager du et bedre billede af atomskyer? Spejle - masser af spejle
- Slowmotion elektroner:Ionfysik på femtosekundsskalaen
- En ikke-destruktiv metode til at analysere molekyler i celler
- Sådan mærker du kulturelle produkter på oversøiske markeder


