Hvad er massen på 1 liter helium og luft?
Antagelser:
* Vi antager standardtemperatur og tryk (STP), som er 0 ° C (273,15 K) og 1 atmosfære af tryk.
* Vi bruger den gennemsnitlige molære luftmasse, som er ca. 28,97 g/mol.
helium
* Molær masse af helium (HE): 4,003 g/mol
* Ideel gaslov: PV =NRT (hvor p =tryk, v =volumen, n =antal mol, r =ideel gaskonstant, t =temperatur)
* løsning for N (antal mol): N =PV/RT
* tilslutning af værdier: n =(1 atm) (1 l) / (0,0821 l*atm / mol*k) (273,15 K) =0,0446 mol
* Mass af helium: masse =n * molmasse =(0,0446 mol) * (4,003 g/mol) = 0,179 gram
luft
* Molær luftmasse: 28,97 g/mol
* ved hjælp af den samme ideelle gaslov og beregninger som ovenfor finder vi antallet af mol luft til at være 0,0446 mol.
* luftmasse: masse =n * molmasse =(0,0446 mol) * (28,97 g/mol) = 1,29 gram
Derfor:
* Massen på 1 liter helium ved STP er cirka 0,179 gram .
* Massen på 1 liter luft ved STP er cirka 1,29 gram .
 Varme artikler
Varme artikler
-
 Forskerteam udvikler en ny metode til at studere atomstrukturer i materialefladerFørste forfatter til den aktuelle undersøgelse Tobias Helk (l.) Og Dr. Frederik Tuitje i et laserlaboratorium ved University of Jena. Kredit:Jens Meyer/University of Jena Kemiske reaktioner, såsom
Forskerteam udvikler en ny metode til at studere atomstrukturer i materialefladerFørste forfatter til den aktuelle undersøgelse Tobias Helk (l.) Og Dr. Frederik Tuitje i et laserlaboratorium ved University of Jena. Kredit:Jens Meyer/University of Jena Kemiske reaktioner, såsom -
 K-kernen som en forudsigelse af strukturelt sammenbrud i mutualistiske økosystemerKredit:City College of New York En netværksmetrik kaldet K-kernen kunne forudsige strukturelt sammenbrud i gensidige økosystemer, ifølge forskning foretaget af fysikere ved The City College i New
K-kernen som en forudsigelse af strukturelt sammenbrud i mutualistiske økosystemerKredit:City College of New York En netværksmetrik kaldet K-kernen kunne forudsige strukturelt sammenbrud i gensidige økosystemer, ifølge forskning foretaget af fysikere ved The City College i New -
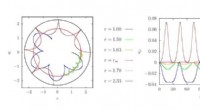 Hvordan en partikel kan stå stille i roterende rumtidNår en partikel med et bestemt vinkelmoment er placeret i den kritiske afstand først, den forbliver i ro, mens rumtiden roterer rundt om den. Jo tættere en partikel er på denne kritiske afstand, jo la
Hvordan en partikel kan stå stille i roterende rumtidNår en partikel med et bestemt vinkelmoment er placeret i den kritiske afstand først, den forbliver i ro, mens rumtiden roterer rundt om den. Jo tættere en partikel er på denne kritiske afstand, jo la -
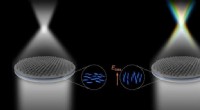 Flydende krystal integrerede metaller til alsidig farvefokusFlydende krystal integrerede metaller. Kredit:Zhixiong Shen et al., Nanjing Universitet. Udviklingen af metasurfaces åbnede en horisont for fremskridt inden for plan optik. Blandt metadevices, m
Flydende krystal integrerede metaller til alsidig farvefokusFlydende krystal integrerede metaller. Kredit:Zhixiong Shen et al., Nanjing Universitet. Udviklingen af metasurfaces åbnede en horisont for fremskridt inden for plan optik. Blandt metadevices, m
- Hvilken type energi flyder en ballon?
- Miljøforkæmpere sagsøger regeringen for Lake Eries giftige alger
- Sådan beskytter du personlige data på enheder, du planlægger at sælge
- Emissionerne steg uholdbare 2 % i 2018:undersøgelse
- Flokmentalitet:Er vi programmeret til at træffe dårlige beslutninger?
- Hvilken type blanding er røg?


