Hvordan tiltrækker afstanden mellem partikler?
* Elektrostatiske kræfter: Disse kræfter stammer fra tiltrækningen mellem modsatte anklager. Positivt ladede partikler tiltrækker negativt ladede partikler. Dette er en grundlæggende kraft, der spiller en vigtig rolle i at holde atomer sammen i molekyler og molekyler sammen i faste stoffer og væsker.
* gravitationskræfter: Mens meget svagere end elektrostatiske kræfter, er tyngdekraften altid attraktiv. Det virker mellem to objekter med masse, inklusive partikler. Imidlertid bliver tyngdekraften kun betydelig i større skalaer som planeter eller stjerner.
* van der Waals Forces: Dette er svagere kræfter, der opstår som følge af midlertidige udsving i elektronfordeling omkring atomer. De er ansvarlige for attraktioner mellem ikke -polære molekyler og spiller en rolle i at holde nogle væsker og faste stoffer sammen.
hvordan afstand påvirker tiltrækning:
* Elektrostatiske kræfter: Styrken af elektrostatisk tiltrækning falder hurtigt, når afstanden mellem partikler øges. Dette følger en omvendt firkantet lov, hvilket betyder, at hvis du fordobler afstanden, bliver tiltrækningen fire gange svagere.
* gravitationskræfter: Tilsvarende falder tyngdekraftsattraktion også med afstand efter en omvendt firkantet lov.
* van der Waals Forces: Disse kræfter er endnu mere følsomme over for afstand. De er meget kortdistancekræfter, hvilket betyder, at de bliver ubetydelige ud over en bestemt afstand.
Kortfattet:
Mens afstand ikke direkte tiltrækker partikler, spiller den en afgørende rolle i bestemmelsen af styrken af attraktive kræfter mellem dem. Jo længere adskilte partikler er, jo svagere tiltrækningen mellem dem, uanset hvilken type kraft involveret.
 Varme artikler
Varme artikler
-
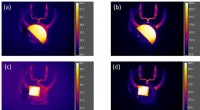 Ny metode måler temperaturen inden for 3D-objekterEt infrarødt billede af det smeltede silicavindue, der bruges til at teste dybdetermografikonceptet. Til projektet, holdet opvarmede silica, en glasart, og analyserede det ved hjælp af et spektrometer
Ny metode måler temperaturen inden for 3D-objekterEt infrarødt billede af det smeltede silicavindue, der bruges til at teste dybdetermografikonceptet. Til projektet, holdet opvarmede silica, en glasart, og analyserede det ved hjælp af et spektrometer -
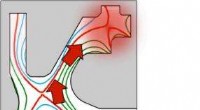 Fusionsreaktordesign med lange ben viser løfteTværsnit af et tokamak-plasma, med cylindrisk symmetriakse i venstre side, viser en potentiel løsning på fusionskraftudstødningsudfordringen:(1) symmetrisk kerneplasma fra top til bund, defineret af m
Fusionsreaktordesign med lange ben viser løfteTværsnit af et tokamak-plasma, med cylindrisk symmetriakse i venstre side, viser en potentiel løsning på fusionskraftudstødningsudfordringen:(1) symmetrisk kerneplasma fra top til bund, defineret af m -
 Lille slæbebåd udløser kryogene strømmeEn krystal af samarium hexaborid sidder suspenderet mellem to titanium understøtninger. Kredit:A. Stern/UCI Forskere har fundet ud af, at en lille strækning er nok til at frigøre de eksotiske elek
Lille slæbebåd udløser kryogene strømmeEn krystal af samarium hexaborid sidder suspenderet mellem to titanium understøtninger. Kredit:A. Stern/UCI Forskere har fundet ud af, at en lille strækning er nok til at frigøre de eksotiske elek -
 Kosmiske stråler kan have efterladt et uudsletteligt aftryk i det tidlige liv, siger fysikereByger af partikler med høj energi, der stammer fra solen og vores galakse, kolliderer med nitrogen og ilt i den øvre atmosfære. På jordoverfladen, brusebadet domineres af magnetisk polariserede muoner
Kosmiske stråler kan have efterladt et uudsletteligt aftryk i det tidlige liv, siger fysikereByger af partikler med høj energi, der stammer fra solen og vores galakse, kolliderer med nitrogen og ilt i den øvre atmosfære. På jordoverfladen, brusebadet domineres af magnetisk polariserede muoner
- Begrænsning af kemien af kulstofkædemolekyler i rummet
- Fejlfinding af en elektrisk motor Hum
- Energien i biomasse bruges til at fremstille elektricitet, hvordan den lagrede biomasse?
- Er nul hastigheden af et objekt i hvile?
- Hvad er svaret på store landmasser på overfladen jord?
- Hvad er en fjerdedel af vejen gennem månecyklus?


