Hvorfor forudsiger klassisk fysik, at atomer skal kollapse?
Den klassiske opfattelse:
* Elektroner som små partikler: Klassisk fysik behandler elektroner som små, negativt ladede partikler, der kredser om den positivt ladede kerne, ligesom planeter kredserer solen.
* Elektromagnetisme: I henhold til klassisk elektromagnetisme bør en accelererende ladet partikel (som en kredsende elektron) udstråle energi. Denne stråling ville få elektronet til at miste energi og spiral indad mod kernen og i sidste ende kollapse ind i den.
Hvorfor er dette forkert:
* kvantemekanik: Problemet er, at klassisk fysik ikke nøjagtigt beskriver elektronernes opførsel på atomniveau. Kvantemekanik, der styrer den meget lille verden, viser, at elektroner opfører sig mere som bølger end partikler.
* Kvantiserede energiniveau: Elektroner i atomer kan kun eksistere i specifikke energiniveauer, som trin på en stige. De kan hoppe mellem disse niveauer ved at absorbere eller udsende energi, men de kan ikke eksistere imellem.
* jordtilstanden: Der er et laveste energiniveau kaldet jordtilstand. Elektroner i jordtilstanden kan ikke miste mere energi og kan derfor ikke kollapse i kernen.
Kortfattet:
Klassisk fysik undlader at forklare atomernes stabilitet, fordi den ikke tager højde for elektronernes kvante karakter. Kvantemekanik giver en mere nøjagtig beskrivelse af atomstruktur og forklarer, hvorfor atomer ikke kollapser.
 Varme artikler
Varme artikler
-
 Forsker fokuserer på et kritisk punkt for at forbedre superledereKredit:CC0 Public Domain Jagten på en superleder, der kan arbejde under mindre ekstreme forhold end hundreder af grader under nul eller ved tryk som dem nær Jordens centrum, er en søgen efter en r
Forsker fokuserer på et kritisk punkt for at forbedre superledereKredit:CC0 Public Domain Jagten på en superleder, der kan arbejde under mindre ekstreme forhold end hundreder af grader under nul eller ved tryk som dem nær Jordens centrum, er en søgen efter en r -
 Sådan fremstilles den reneste argon nogensindeARIAs moduler bliver lækagetestet på CERN, inden de rejser til Sardinien, Italien. Toppen, bund og et standard kolonnemodul er nu opstillet vandret for at teste deres justering. Kredit:J. Ordan/CERN
Sådan fremstilles den reneste argon nogensindeARIAs moduler bliver lækagetestet på CERN, inden de rejser til Sardinien, Italien. Toppen, bund og et standard kolonnemodul er nu opstillet vandret for at teste deres justering. Kredit:J. Ordan/CERN -
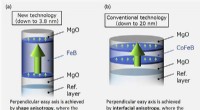 Et hidtil uset encifret-nanometer magnetisk tunnelkryds demonstreretSkema for formanisotropi MTJ (a) og grænsefladeanisotropi MTJ (b). Den formanisotropiske MTJ har en struktur som en stangmagnet stående. Kredit:Shunsuke Fukami En forskergruppe fra Tohoku Universi
Et hidtil uset encifret-nanometer magnetisk tunnelkryds demonstreretSkema for formanisotropi MTJ (a) og grænsefladeanisotropi MTJ (b). Den formanisotropiske MTJ har en struktur som en stangmagnet stående. Kredit:Shunsuke Fukami En forskergruppe fra Tohoku Universi -
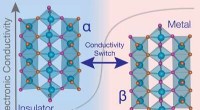 Nyt materiale skifter mellem elektrisk ledende og isolerende tilstandeForskere fandt metal-isolatorovergangen i materialet molybdænoxynitrid forekommet nær 600 grader Celsius, afslører dets potentiale for applikationer i højtemperaturfølere og effektelektronik. Kredit:N
Nyt materiale skifter mellem elektrisk ledende og isolerende tilstandeForskere fandt metal-isolatorovergangen i materialet molybdænoxynitrid forekommet nær 600 grader Celsius, afslører dets potentiale for applikationer i højtemperaturfølere og effektelektronik. Kredit:N


