Hvorfor elektron elliptisk sti?
Her er en sammenbrud af hvorfor:
* Bohr Model: Selvom denne model historisk er signifikant, skildrer elektroner, der kredser om kernen i definerede cirkulære stier. Det er et nyttigt udgangspunkt for at forstå grundlæggende atomstruktur, men unøjagtigt i at skildre elektronernes sande opførsel.
* kvantemekanik: Den moderne forståelse af atomstruktur er afhængig af kvantemekanik. Denne teori siger, at elektroner ikke følger klassiske kredsløb som planeter omkring en stjerne. I stedet besætter de sandsynlighedsskyer kaldes atomiske orbitaler.
* atomiske orbitaler: Disse orbitaler repræsenterer regioner i rummet, hvor der sandsynligvis findes et elektron. De har forskellige former, herunder sfæriske (s orbitaler), håndvægtformede (P orbitaler) og mere komplekse former (D og F orbitaler).
* Energiniveau: Elektroner findes i forskellige energiniveauer inden for atomet. Hvert energiniveau svarer til et sæt orbitaler.
Så hvorfor ser vi undertiden elliptiske former forbundet med elektroner?
* Overgange: Når en elektron bevæger sig mellem energiniveauet, kan det undertiden midlertidigt besætte en tilstand, der ligner en elliptisk bane. Dette er et kortvarigt fænomen kaldet en ophidset tilstand.
* Matematiske modeller: Visse kvantemekaniske modeller bruger elliptiske funktioner til at beskrive elektronernes opførsel, men disse modeller er forenklinger og repræsenterer ikke det komplette billede.
Afslutningsvis følger elektroner ikke elliptiske stier i klassisk forstand. Deres opførsel styres af kvantemekanik, og de findes i sandsynlighedsskyer kaldet atomiske orbitaler.
Sidste artikelHvorfor passerer fotonerne igennem materiale?
Næste artikelEr masse og hastighed lige kraft?
 Varme artikler
Varme artikler
-
 Første undersøgelse af nikkelatmagnetisme finder et stærkt slægtskab med cuprat-superledereDe første målinger af magnetiske excitationer, der risler gennem en nikkel -superleder, viser, at den har et stærkt slægtskab med cuprate -superledere, som den til venstre, i modsætning til det mere f
Første undersøgelse af nikkelatmagnetisme finder et stærkt slægtskab med cuprat-superledereDe første målinger af magnetiske excitationer, der risler gennem en nikkel -superleder, viser, at den har et stærkt slægtskab med cuprate -superledere, som den til venstre, i modsætning til det mere f -
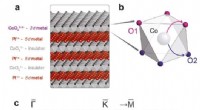 Fysisk forskning i kondenseret stof kunne revolutionere dataoverførsel og lagringFigur 1:a) I bulk, (Pt, Pd)CoO2 kan opfattes som en vekslende stak af metalliske og isolerende lag. Polær ladning ved den CoO2-terminerede overflade gør imidlertid overfladelaget metallisk, og tillade
Fysisk forskning i kondenseret stof kunne revolutionere dataoverførsel og lagringFigur 1:a) I bulk, (Pt, Pd)CoO2 kan opfattes som en vekslende stak af metalliske og isolerende lag. Polær ladning ved den CoO2-terminerede overflade gør imidlertid overfladelaget metallisk, og tillade -
 Forskere skaber MR-lignende teknik til billeddannelse af magnetiske bølgerKredit:TU Delft/Scixel Et team af forskere fra Delft University of Technology (TU Delft), Leiden Universitet, Tohoku University og Max Planck Institute for the Structure and Dynamics of Matter har
Forskere skaber MR-lignende teknik til billeddannelse af magnetiske bølgerKredit:TU Delft/Scixel Et team af forskere fra Delft University of Technology (TU Delft), Leiden Universitet, Tohoku University og Max Planck Institute for the Structure and Dynamics of Matter har -
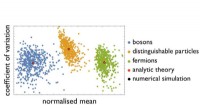 Udvikling af pålidelige kvantecomputereKvanteoptik og statistik. Kredit:University of Freiburg Kvantecomputere kan en dag løse algoritmiske problemer, som selv de største supercomputere i dag ikke kan klare. Men hvordan tester du en kv
Udvikling af pålidelige kvantecomputereKvanteoptik og statistik. Kredit:University of Freiburg Kvantecomputere kan en dag løse algoritmiske problemer, som selv de største supercomputere i dag ikke kan klare. Men hvordan tester du en kv
- Forskere udvikler minimale nanozymer med kuldioxidopfangningskapacitet
- I nanorod krystalvækst, nanopartikler set som kunstige atomer
- Hvordan Virtual Reality Militære applikationer fungerer
- Konjugering overfører en egenskab fra en bakterie til en anden via en lille DNA-streng kaldet plasm…
- Hvad findes i midten af en kernecelle?
- Hvorfor hjælper gratis elektroner metaller med at udføre?


