Hvad er den gennemsnitlige hastighed for atomer?
* Temperatur: Jo varmere atomet er, jo hurtigere bevæger den sig.
* atomtype: Forskellige atomer har forskellige masser, og tungere atomer bevæger sig langsommere ved den samme temperatur.
* Matterilat: Atomer i et fast stof er mindre mobile end atomer i en gas.
Her er en sammenbrud:
* i en gas: Atomer bevæger sig ganske frit og kolliderer ofte. Deres gennemsnitlige hastighed kan beregnes ved hjælp af rod-middel-square (RMS) hastighed:
`` `
v_rms =√ (3kt/m)
`` `
Hvor:
* k er Boltzmanns konstant (1,38 x 10^-23 j/k)
* T er temperaturen i Kelvin
* m er atomets masse
* i en væske: Atomer bevæger sig mindre frit end i en gas, men har stadig betydelig kinetisk energi. Deres gennemsnitlige hastighed er lavere end i en gas, men den er stadig påvirket af temperatur.
* i et solidt: Atomer er tæt bundet sammen og vibrerer rundt om faste positioner. Mens de har en vis mængde vibrationsenergi, er deres gennemsnitlige hastighed meget lavere end i væsker eller gasser.
Eksempler:
* Ved stuetemperatur (298 K) er RMS -hastigheden af et nitrogenmolekyle (N2) omkring 515 m/s.
* RMS -hastigheden af et heliumatom (HE) ved den samme temperatur er ca. 1360 m/s, der viser, at lettere atomer bevæger sig hurtigere.
Kortfattet: Den gennemsnitlige hastighed for atomer afhænger af temperatur, atomtype og stofstilstand. Begrebet "gennemsnitlig hastighed" er ofte repræsenteret af rod-middel-kvadrathastigheden for atomer i en gas.
Sidste artikelHvem er den bedste erhverv i fysik?
Næste artikelHvad er de fire kræfter, der handler på flyvende genstande?
 Varme artikler
Varme artikler
-
 Forskere skaber optiske præcisionskomponenter med inkjet-printForskere udviklede en to-trins inkjet printteknik, der kan lave optiske komponenter kendt som bølgeledere (a). En række dråber kaldet pinning caps udskrives først (hvide). Væskebroer mellem stifthætte
Forskere skaber optiske præcisionskomponenter med inkjet-printForskere udviklede en to-trins inkjet printteknik, der kan lave optiske komponenter kendt som bølgeledere (a). En række dråber kaldet pinning caps udskrives først (hvide). Væskebroer mellem stifthætte -
 Ny superledende qubit testbed gavner udvikling af kvanteinformationsvidenskabEn superledende qubit sidder i et fortyndingskøleskab i et Pacific Northwest National Laboratory (PNNL) fysiklaboratorium. Denne eksperimentelle enhed er det første trin i etableringen af en qubit t
Ny superledende qubit testbed gavner udvikling af kvanteinformationsvidenskabEn superledende qubit sidder i et fortyndingskøleskab i et Pacific Northwest National Laboratory (PNNL) fysiklaboratorium. Denne eksperimentelle enhed er det første trin i etableringen af en qubit t -
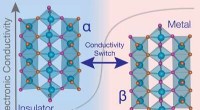 Nyt materiale skifter mellem elektrisk ledende og isolerende tilstandeForskere fandt metal-isolatorovergangen i materialet molybdænoxynitrid forekommet nær 600 grader Celsius, afslører dets potentiale for applikationer i højtemperaturfølere og effektelektronik. Kredit:N
Nyt materiale skifter mellem elektrisk ledende og isolerende tilstandeForskere fandt metal-isolatorovergangen i materialet molybdænoxynitrid forekommet nær 600 grader Celsius, afslører dets potentiale for applikationer i højtemperaturfølere og effektelektronik. Kredit:N -
 Nye optiske moduler kan forbedre screening af skjoldbruskkirtlenEU-projektet Laser and Ultrasound Co-analyzer for Thyroid Nodules (LUCA) har til formål at udvikle en ny, ikke-invasiv billig enhed, der vil give mere specifikke resultater i screening af skjoldbruskk
Nye optiske moduler kan forbedre screening af skjoldbruskkirtlenEU-projektet Laser and Ultrasound Co-analyzer for Thyroid Nodules (LUCA) har til formål at udvikle en ny, ikke-invasiv billig enhed, der vil give mere specifikke resultater i screening af skjoldbruskk
- Hvad er positiv accelerationsformel?
- Hvorfor er størrelse omtrent den samme som bølgelængde af bølger i diffraktion?
- Hvad kaldes en konsolideret klippe?
- Fysikere fanger de første billeder af atomspin
- Hvem skabte bølgeligningerne?
- Forskerhold rapporterer om ny tilgang til simulering af varmeoverførsel i nanoskala


