Hvad er definitionen af temperatur i fysik?
Her er en sammenbrud af definitionen:
* kinetisk energi: Dette henviser til den energi, som et objekt besidder på grund af dets bevægelse. I et system med partikler, såsom en gas eller en fast stof, har hver partikel sin egen kinetiske energi baseret på dens hastighed.
* gennemsnit: Temperatur måler den gennemsnitlige kinetiske energi for alle partikler i et system. Dette betyder, at det fortæller os den typiske energi i en partikel, ikke nødvendigvis energien i nogen specifik partikel.
* system: Et system kan være et specifikt objekt, en region af rummet eller endda en samling af objekter.
* varme: Mens temperaturen ofte forveksles med varme, er de forskellige. varme er overførslen af termisk energi mellem genstande ved forskellige temperaturer. Temperaturen er et mål for den interne energi i et system, mens varme er strømmen af energi mellem systemer.
Nøglepunkter:
* Temperatur er en skalær mængde, hvilket betyder, at den kun har størrelse, ikke retning.
* Temperatur måles typisk i grader Celsius (° C), grader Fahrenheit (° F) eller Kelvin (K). Kelvin er SI -enheden for temperatur.
* Temperatur er relateret til den interne energi i et system. Når temperaturen stiger, øges systemets indre energi også.
Eksempler:
* En varm kop kaffe har en højere temperatur end et koldt glas vand, fordi vandmolekylerne i kaffen i gennemsnit bevæger sig hurtigere end vandmolekylerne i vandet.
* En blok af metal opvarmet i en ovn vil have en højere temperatur end selve ovnen, fordi metalmolekylerne vibrerer mere kraftigt.
Bemærk: Denne definition er en forenkling af de mere komplekse begreber om statistisk mekanik og termodynamik. Det giver dog en grundlæggende forståelse af, hvad temperaturen er, og hvordan den relaterer til energien fra partikler i et system.
Sidste artikelHvad sker der med fart, når massen falder?
Næste artikelHvad er formlen i solingskraft?
 Varme artikler
Varme artikler
-
 Ny metode til at spore ultrahurtig ændring af magnetisk tilstandI det nye studie sammen med deres internationale kolleger, Professor dr. Dmitry Turchinovich (til venstre) og Wentao Zhang demonstrerer, hvordan den ultrahurtige ændring af magnetiske tilstande kan må
Ny metode til at spore ultrahurtig ændring af magnetisk tilstandI det nye studie sammen med deres internationale kolleger, Professor dr. Dmitry Turchinovich (til venstre) og Wentao Zhang demonstrerer, hvordan den ultrahurtige ændring af magnetiske tilstande kan må -
 Blæksprutternes evne til at justere farve og lysstyrke af deres iriserende kommer ned til en subtil…Kredit:CC0 Public Domain Blæksprutter har længe været en kilde til fascination for mennesker, leverer sagn, overtro og myter. Og det er ikke så mærkeligt - deres mærkelige udseende og mærkelige in
Blæksprutternes evne til at justere farve og lysstyrke af deres iriserende kommer ned til en subtil…Kredit:CC0 Public Domain Blæksprutter har længe været en kilde til fascination for mennesker, leverer sagn, overtro og myter. Og det er ikke så mærkeligt - deres mærkelige udseende og mærkelige in -
 Undersøgelse viser, hvordan ru mikropartikler kan give store problemerDet øverste panel er en serie af scanningselektronmikrofotografier for partikler, der spænder fra glatte til ru. Det nederste panel er en række atomkraftmikrografier, der viser 3D-topografien af dis
Undersøgelse viser, hvordan ru mikropartikler kan give store problemerDet øverste panel er en serie af scanningselektronmikrofotografier for partikler, der spænder fra glatte til ru. Det nederste panel er en række atomkraftmikrografier, der viser 3D-topografien af dis -
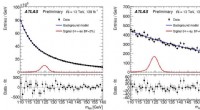 ATLAS Experiment frigiver ny søgning efter Higgs boson -interaktioner med den letteste ladede lepto…Ee (venstre) og eµ (højre) invariante massefordelinger. Det forventede signal for et specifikt forgreningsforhold vises med den røde linje. En tilpasning til dataene, forudsat fravær af signal, er vis
ATLAS Experiment frigiver ny søgning efter Higgs boson -interaktioner med den letteste ladede lepto…Ee (venstre) og eµ (højre) invariante massefordelinger. Det forventede signal for et specifikt forgreningsforhold vises med den røde linje. En tilpasning til dataene, forudsat fravær af signal, er vis
- Emission fra blazaren 1ES 1218+304 udforsket med NASA-rumteleskoper
- Hvad er inputenergien fra en blender?
- Hvorfor kaliumchromat er mere opløseligt end sølvchlorid?
- Hvilken by landsby eller by nær Colima Volcano?
- IBM lancerer kommerciel kvanteberegning – var ikke klar til det næste
- Kortlægning af en kurs mod kvantesimuleringer af kernefysik


