Hvorfor kaliumchromat er mere opløseligt end sølvchlorid?
opløselighedsregler
* generel regel: De fleste kaliumsalte er opløselige.
* Specifik regel: De fleste chloridsalte er opløselige, * undtagen * for sølv, bly (II) og kviksølv (I).
Forklaring
* kaliumchromat (k₂cro₄): Kalium, der er et gruppe 1 -element, danner meget opløselige salte på grund af den stærke tiltrækning mellem kaliumkationen (K⁺) og kromatanionen (Cro₄²⁻).
* sølvchlorid (AGCL): Sølv er en af undtagelserne fra den generelle regel for chloridsalte. Sølvchlorid danner en stærk ionisk binding, men gitterenergien (den energi, der kræves for at bryde krystalgitteret) er relativt høj. Dette gør det mindre opløseligt i vand.
Nøglefaktorer, der påvirker opløselighed
* ionstyrke: Kaliumchromat har en højere ionstyrke sammenlignet med sølvchlorid, hvilket gør dets ioner mere tilbøjelige til at interagere med vandmolekyler og opløses.
* gitterenergi: Gitterenergien i sølvchlorid er højere end kaliumchromat. Dette betyder, at det tager mere energi at bryde sølvchloridkrystallgitteret og opløse det i vand.
* Polaritet: Kromatanionen er mere polær end chloridanionen, hvilket gør det mere tiltrukket af vandmolekyler (som også er polære).
Kortfattet
Kombinationen af kaliumchromats høje ionstyrke, lavere gitterenergi og mere polær karakter sammenlignet med sølvchlorid resulterer i dets større opløselighed i vand.
Sidste artikelHvad er nogle landformer foretaget ved kemisk forvitring?
Næste artikelHvad er fire hovedfaser i overfladen?
 Varme artikler
Varme artikler
-
 Bioengineer har til formål at forvandle naturens virusbekæmpere til kraftfulde stofferKredit:CC0 Public Domain Blandt de kraftfulde biokemikalier i det menneskelige immunsystem, peptider er en af de bedste. Findes oftest på de steder, hvor mikrober elsker at slå rod - øjets slim
Bioengineer har til formål at forvandle naturens virusbekæmpere til kraftfulde stofferKredit:CC0 Public Domain Blandt de kraftfulde biokemikalier i det menneskelige immunsystem, peptider er en af de bedste. Findes oftest på de steder, hvor mikrober elsker at slå rod - øjets slim -
 Molekyler, der bremser vildfarne proteiner af AL-amyloidose, peger på en ny type terapiKrystalstruktur af et antistofprotein fundet i letkædede amyloidoser, med succes stabiliseret af små molekyler identificeret i Kelly Lab. Kredit:Scripps Research Institute Forskere ved Scripps Res
Molekyler, der bremser vildfarne proteiner af AL-amyloidose, peger på en ny type terapiKrystalstruktur af et antistofprotein fundet i letkædede amyloidoser, med succes stabiliseret af små molekyler identificeret i Kelly Lab. Kredit:Scripps Research Institute Forskere ved Scripps Res -
 Maskinindlæringssoftware forudsiger bakteriers adfærdEn kunstners skildring af en bakteriecelle. Kredit:Centers for Disease Control and Prevention/James Archer I den første til maskinlæringsalgoritmer, et nyt stykke software udviklet hos Caltech kan
Maskinindlæringssoftware forudsiger bakteriers adfærdEn kunstners skildring af en bakteriecelle. Kredit:Centers for Disease Control and Prevention/James Archer I den første til maskinlæringsalgoritmer, et nyt stykke software udviklet hos Caltech kan -
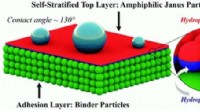 Forskning viser potentiale til at forbedre maling, belægningerKredit: Materialer Horisonter (2020). DOI:10.1039/D0MH00589D Ny forskning fra Binghamton University, State University of New York kan føre til mere miljøvenlige malinger og belægninger. I romers
Forskning viser potentiale til at forbedre maling, belægningerKredit: Materialer Horisonter (2020). DOI:10.1039/D0MH00589D Ny forskning fra Binghamton University, State University of New York kan føre til mere miljøvenlige malinger og belægninger. I romers
- Hvor er jernoxid på det periodiske tabel?
- Hvorfor er planteformering en effektiv måde for folk at fremstille nye planter på?
- Hvad er formlen for hydrid dannet af Rubidium?
- Videnskabelige Projekter Med Straws
- Abiotiske og biotiske faktorer i økosystemer
- Hvorfor ændrer konstellationer på himlen sig hele natten?


