Hvorfor ophører al molekylær bevægelse ved 0 Kelvin?
Nulpunktsenergien:
* Selv ved absolut nul (0 Kelvin eller -273,15 ° C) har molekyler stadig et minimumsmængde energi kaldet nul -point energi . Denne energi er en konsekvens af kvantemekanik og er relateret til Heisenberg -usikkerhedsprincippet.
* Usikkerhedsprincippet siger, at vi ikke kan kende både en partikels position og momentum med perfekt nøjagtighed. Denne iboende usikkerhed betyder, at selv ved absolut nul kan molekyler ikke være perfekt stadig.
* Derfor oplever molekylerne på absolut nul, at molekyler nulpunktsbevægelse , et minimalt niveau af vibration og bevægelse.
Hvorfor molekylær bevægelse falder med temperatur:
* Temperatur er et mål for den gennemsnitlige kinetiske energi af molekyler. Kinetisk energi er bevægelsesenergien.
* Når temperaturen falder, falder den gennemsnitlige kinetiske energi af molekyler. Dette betyder, at molekylerne i gennemsnit bevæger sig langsommere.
* Hos Absolute Zero ville den gennemsnitlige kinetiske energi af molekyler teoretisk nå sin minimumsværdi, men det ville ikke være nul på grund af nulpunktsenergien.
Vigtig note:
* Absolute Zero er et teoretisk koncept. Det er umuligt at nå absolut nul i praksis, da det ville kræve at fjerne al energi fra et system, hvilket er umuligt på grund af kvanteeffekter.
Kortfattet:
Mens molekylær bevægelse bremser markant, når temperaturen nærmer sig absolut nul, ophører den ikke helt på grund af den iboende nulpunktsenergi. Denne energi sikrer, at selv ved den koldeste mulige temperatur udviser molekyler stadig et minimalt bevægelsesniveau.
 Varme artikler
Varme artikler
-
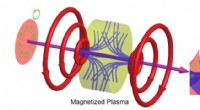 Magnetiserede plasmaer, der vrider lys, kan producere kraftfulde mikroskoper og mereKonvertering af en gaussisk laserstråle til en optisk hvirvel i magnetiseret plasma. En input -gaussisk laserstråle sendes gennem et plasma, som medieres i et aksialt symmetrisk magnetfelt genereret a
Magnetiserede plasmaer, der vrider lys, kan producere kraftfulde mikroskoper og mereKonvertering af en gaussisk laserstråle til en optisk hvirvel i magnetiseret plasma. En input -gaussisk laserstråle sendes gennem et plasma, som medieres i et aksialt symmetrisk magnetfelt genereret a -
 Forskere bruger trelagsgrafen til at observere mere robust superledningKunstnerfortolkning af snoet trelagsgrafen. Kredit:Polina Shmatkova &Margarita Davydova I 2018, fysikkens verden blev sat i brand med opdagelsen af, at når et ultratyndt lag kulstof, kaldet grafen
Forskere bruger trelagsgrafen til at observere mere robust superledningKunstnerfortolkning af snoet trelagsgrafen. Kredit:Polina Shmatkova &Margarita Davydova I 2018, fysikkens verden blev sat i brand med opdagelsen af, at når et ultratyndt lag kulstof, kaldet grafen -
 Flydende mekanik i bordtennisbolde-opdagelse af spin-kriseTre rotor lanceringsmaskine Chiquita. Kredit:University of Electro-Communications Forskning udført af Takeshi Miyazaki og kolleger på Complex Fluids Lab på UEC, Tokyo, dækker miljøvæskemekanik i m
Flydende mekanik i bordtennisbolde-opdagelse af spin-kriseTre rotor lanceringsmaskine Chiquita. Kredit:University of Electro-Communications Forskning udført af Takeshi Miyazaki og kolleger på Complex Fluids Lab på UEC, Tokyo, dækker miljøvæskemekanik i m -
 Forskere registrerer stærk toroidal dipolrespons i et bredt frekvensområdeEksperimentel struktur med et stærkt toroidalt dipolrespons. Kredit:ITMO University Fysikere har formået at skabe en eksperimentel struktur med et stærkt toroidalt dipolrespons af det elektromagne
Forskere registrerer stærk toroidal dipolrespons i et bredt frekvensområdeEksperimentel struktur med et stærkt toroidalt dipolrespons. Kredit:ITMO University Fysikere har formået at skabe en eksperimentel struktur med et stærkt toroidalt dipolrespons af det elektromagne
- Når en komfur koger vand Hvilken type energitransformation forekommer?
- Human Genome DNA Sequence Types
- Hvilket navn et instrument, der ville blive brugt til at måle slutspil af en skaft?
- Hvad er nogle planter, der er hjemmehørende i Belgien?
- Er kviksølv mindre end månen?
- Team udvikler natriumionbatterier ved hjælp af kobbersulfid


