Hvad var hypotesen i eksperimentet med Ernest Rutherford?
Her er en sammenbrud af situationen:
* den herskende teori (Thomsons Plum Pudding Model): På det tidspunkt troede forskere, at atomet var en positivt ladet sfære med elektroner indlejret i det, som blommer i en budding.
* Rutherfords forventning: Rutherford mistænkte, at atomets positive ladning var koncentreret i en meget mindre, tættere region, som han senere ville kalde kernen.
* eksperimentet: Rutherford sigtede en stråle af alfa -partikler (positivt ladede partikler) ved en tynd guldfolie. Han forventede, at alfa -partiklerne ville passere lige gennem folien, hvis atomet faktisk var en diffus, positivt ladet sfære.
* De overraskende resultater: Til hans forbløffelse blev et betydeligt antal alfapartikler afbøjet i store vinkler, og nogle sprang endda tilbage direkte. Dette uventede resultat modsatte den herskende teori.
Derfor var Rutherfords "hypotese" ikke en bestemt erklæring, som han forsøgte at bevise. I stedet var det et spørgsmål om den eksisterende model og en søgning efter en mere nøjagtig repræsentation af atomet.
Resultaterne af eksperimentet førte til, at han foreslog atomets nukleare model , hvor en tæt, positivt ladet kerne er omgivet af negativt ladede elektroner, der kredserer den.
I det væsentlige handlede Rutherfords eksperiment ikke om at bevise en specifik hypotese, men snarere om at udfordre en accepteret teori og opdage en mere nøjagtig repræsentation af atomet.
Sidste artikelHvilke fysiske mængder er repræsenteret af aksiale vektorer?
Næste artikelHvordan kan et objekt have negativ momentum?
 Varme artikler
Varme artikler
-
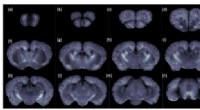 Ny billedbehandlingstilgang kortlægger ændringer i hele hjernen fra Alzheimers sygdom hos musVed at bruge cryo-MOST, forskerne anskaffede et hjernedækkende kort over en Alzheimer-musemodel, der viste, at senile plaques havde spredt sig til hele hjernen. Billederne er med 1-millimeters mellemr
Ny billedbehandlingstilgang kortlægger ændringer i hele hjernen fra Alzheimers sygdom hos musVed at bruge cryo-MOST, forskerne anskaffede et hjernedækkende kort over en Alzheimer-musemodel, der viste, at senile plaques havde spredt sig til hele hjernen. Billederne er med 1-millimeters mellemr -
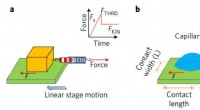 Dråbefriktion viste sig at ligne faste objekterSkema af friktionskraftmålinger. en, Lærebogskonfiguration til demonstration af solid -solid friktion. b, Hjemmelavet opsætning til måling af væske-fast friktion. En dråbe væske placeres på et fast un
Dråbefriktion viste sig at ligne faste objekterSkema af friktionskraftmålinger. en, Lærebogskonfiguration til demonstration af solid -solid friktion. b, Hjemmelavet opsætning til måling af væske-fast friktion. En dråbe væske placeres på et fast un -
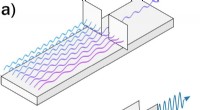 Forskere opnår ekstrem-ultraviolet spektral kompression ved fire-bølge blandingFig. 1:(a) En specifik farve kan vælges fra en bredbåndslyskilde ved hjælp af f.eks. et prisme eller et gitter. Dette kommer, imidlertid, på bekostning af at miste det meste af lyset. (b) Ved at anven
Forskere opnår ekstrem-ultraviolet spektral kompression ved fire-bølge blandingFig. 1:(a) En specifik farve kan vælges fra en bredbåndslyskilde ved hjælp af f.eks. et prisme eller et gitter. Dette kommer, imidlertid, på bekostning af at miste det meste af lyset. (b) Ved at anven -
 Fokuserede røntgenstråler afslører, hvordan sten under højt tryk omdannes til forskellige materi…Det eksperimentelle kammer ved Matter in Extreme Conditions -stationen ved SLACs Linac kohærente lyskilde. Dette kammer blev brugt til et eksperiment, der studerede transformationen af smeltet silic
Fokuserede røntgenstråler afslører, hvordan sten under højt tryk omdannes til forskellige materi…Det eksperimentelle kammer ved Matter in Extreme Conditions -stationen ved SLACs Linac kohærente lyskilde. Dette kammer blev brugt til et eksperiment, der studerede transformationen af smeltet silic
- Er følelsesmæssig intelligens en bedre indikator for hjernens sundhed end IQ?
- Hvordan reagerer brint med ild?
- Hvorfor er en remskive kraftmultiplikator?
- Nyt fossilfund kaster lys over, hvordan mennesker lærte at gå
- Hvad er tre former for energi, som Radiant kan ændre sig?
- Satellitter afslører modtagelighed for tørvemarksbrand


