Hvordan forklarer modellen afbøjningerne af en bjælkealfa -partikler rettet mod arkfolie?
Sådan fungerer det:
1. Atomens struktur: Rutherfords model foreslog, at et atom består af en lille, tæt, positivt ladet kerne i midten, omgivet af negativt ladede elektroner, der kredser om kernen.
2. alfa -partikler: Alfa -partikler er positivt ladede partikler, der udsendes af radioaktivt forfald.
3. eksperimentet: Når alfa -partikler fyres på et tyndt ark guldfolie, passerer de fleste af dem lige uden afbøjning. Dette antydede, at størstedelen af atomet var tomt rum.
4. uventede afbøjninger: Imidlertid blev en lille procentdel af alfa -partiklerne afbøjet i store vinkler, hvor nogle endda sprang tilbage. Dette uventede resultat var nøglen til Rutherfords opdagelse.
5. Forklaring: Rutherford forklarede disse afbøjninger ved at foreslå, at de positivt ladede alfa -partikler blev frastødt af den positivt ladede kerne. Jo større afbøjning, jo tættere kom alfa -partiklen til kernen.
6. kernen: Det faktum, at nogle alfa -partikler blev afbøjet bagud, indebar, at kernen var ekstremt lille og tæt, indeholdende næsten hele atomets masse.
Kortfattet: Rutherford -modellen forklarede afbøjningerne af alfa -partikler ved at postulere en tæt, positivt ladet kerne i midten af atomet. Denne model revolutionerede vores forståelse af atomstruktur og banede vejen for yderligere fremskridt inden for nuklear fysik.
 Varme artikler
Varme artikler
-
 Lær om kvantevakuum ved at studere atomerEn laserstråle rammer en sky af ultrakolde atomer. Kredit:Vienna University of Technology Unruh-effekten forbinder kvanteteori og relativitet. Indtil nu, det kunne ikke måles. En ny idé kunne ændr
Lær om kvantevakuum ved at studere atomerEn laserstråle rammer en sky af ultrakolde atomer. Kredit:Vienna University of Technology Unruh-effekten forbinder kvanteteori og relativitet. Indtil nu, det kunne ikke måles. En ny idé kunne ændr -
 Super Proton Synchrotron til at modtage en ny stråledumpStråledumpens afskærmning samles. Kredit:Maximilien Brice/CERN Ved afslutningen af den anden lange nedlukning (LS2) af CERNs acceleratorkompleks, en ni meter lang genstand med flere hundrede ton
Super Proton Synchrotron til at modtage en ny stråledumpStråledumpens afskærmning samles. Kredit:Maximilien Brice/CERN Ved afslutningen af den anden lange nedlukning (LS2) af CERNs acceleratorkompleks, en ni meter lang genstand med flere hundrede ton -
 Forskere forbedrer dataudlæsning ved at bruge kvanteforviklingerKredit:CC0 Public Domain Forskere siger, at de har været i stand til i høj grad at forbedre udlæsningen af data fra digitale hukommelser - takket være kvantesammenfiltring. Forskerholdet, som o
Forskere forbedrer dataudlæsning ved at bruge kvanteforviklingerKredit:CC0 Public Domain Forskere siger, at de har været i stand til i høj grad at forbedre udlæsningen af data fra digitale hukommelser - takket være kvantesammenfiltring. Forskerholdet, som o -
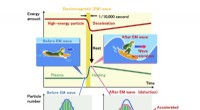 Processen med bølger, der bærer plasmavarme, observeres for første gangVarme bliver båret af elektromagnetiske bølger, som samtidig bremser højhastighedspartikelstrålen (rød linje) og opvarmer plasmapartiklerne (grøn linje). Forvrængning af hastighedsfordelingen observer
Processen med bølger, der bærer plasmavarme, observeres for første gangVarme bliver båret af elektromagnetiske bølger, som samtidig bremser højhastighedspartikelstrålen (rød linje) og opvarmer plasmapartiklerne (grøn linje). Forvrængning af hastighedsfordelingen observer
- Er NH4 plus en binær forbindelse?
- Ny analytisk tilgang til at detektere og karakterisere ukendte typer af PFAS i miljøet
- Hvor mange joule arbejde udføres, når en kraft N flytter bogen 2 meter?
- Hvordan distribueres solisolering på jorden?
- Hvilken type binding dannes mellem et brint på et polært molekyle og meget elektronegativt atom, s…
- Oldtidens jords varme indre skabte kirkegård af kontinentale plader


