Kan nøjagtige sti for en bevægelig elektron forudsiges?
* Heisenbergs usikkerhedsprincip: Dette grundlæggende princip om kvantemekanik siger, at det er umuligt at kende både positionen og momentumet for en partikel (som en elektron) med perfekt nøjagtighed på samme tid. Jo mere præcist du måler den ene, jo mindre præcist kan du måle den anden.
* bølgepartikel dualitet: Elektroner udviser bølglignende egenskaber. Dette betyder, at de ikke rejser langs en enkelt, veldefineret sti. I stedet beskrives deres bevægelse af en sandsynlighedsbølge. Denne bølge giver os sandsynligheden for at finde elektronet på et bestemt sted på et givet tidspunkt.
* kvantefelt: Selv inden for rammerne af sandsynlighedsbølgen er det nøjagtige resultat af en måling (som en elektronposition) i sagens natur tilfældig. Vi kan kun forudsige sandsynligheden for forskellige resultater.
hvad vi kan gøre:
* Beregn sandsynlighedsfordelinger: Vi kan bruge kvantemekanik til at beregne sandsynligheden for at finde en elektron i en bestemt pladsområde på et givet tidspunkt. Disse sandsynlighedsfordelinger giver os en statistisk forståelse af elektronens opførsel.
* simulere elektronadfærd: Sofistikerede computersimuleringer kan modellere den sandsynlige karakter af elektronbevægelse, så vi kan studere dens opførsel i komplekse systemer.
Analogi:
Forestil dig at kaste en pil på et dartboard. Du kan sigte mod et specifikt sted, men du kan ikke forudsige det nøjagtige punkt, hvor DART vil lande. Tilsvarende med et elektron kan vi ikke forudsige dens nøjagtige sti, men vi kan bestemme sandsynligheden for, at IT -landing i en bestemt region.
 Varme artikler
Varme artikler
-
 Tværinstitutionelt samarbejde fører til ny kontrol over quantum dot qubitsEt scanningselektronmikroskop (SEM) billede af en enhed, der er litografisk identisk med den målte, viser gateelektrodelayoutet i det aktive område. Kredit:Eriksson et al. Qubits er byggestenene i
Tværinstitutionelt samarbejde fører til ny kontrol over quantum dot qubitsEt scanningselektronmikroskop (SEM) billede af en enhed, der er litografisk identisk med den målte, viser gateelektrodelayoutet i det aktive område. Kredit:Eriksson et al. Qubits er byggestenene i -
 Mærkelig vridningsgeometri hjælper med at skubbe videnskabelige grænserPrinceton-forskere har bygget et elektronisk array på en mikrochip, der simulerer partikelinteraktioner i et hyperbolsk plan, en geometrisk overflade, hvor rummet krummer væk fra sig selv på hvert pun
Mærkelig vridningsgeometri hjælper med at skubbe videnskabelige grænserPrinceton-forskere har bygget et elektronisk array på en mikrochip, der simulerer partikelinteraktioner i et hyperbolsk plan, en geometrisk overflade, hvor rummet krummer væk fra sig selv på hvert pun -
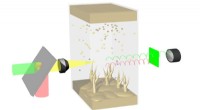 Materialeforskere bruger stimuleret Raman -spredningsmikroskopi til at observere ioner, der bevæger…Skematisk illustration af en Li-Li symmetrisk celle under SRS-billeddannelse. Kredit:Qian Cheng/Columbia Engineering Litiummetalbatterier holder et enormt løfte om næste generations energilagring,
Materialeforskere bruger stimuleret Raman -spredningsmikroskopi til at observere ioner, der bevæger…Skematisk illustration af en Li-Li symmetrisk celle under SRS-billeddannelse. Kredit:Qian Cheng/Columbia Engineering Litiummetalbatterier holder et enormt løfte om næste generations energilagring, -
 Brug af miljøet til at kontrollere kvanteenhederKredit:CC0 Public Domain Singapore University of Technology and Design (SUTD) forskere har afsløret, hvordan miljøet kan påvirke meget følsom kvanteadfærd som lokalisering. Deres fund, udgivet i
Brug af miljøet til at kontrollere kvanteenhederKredit:CC0 Public Domain Singapore University of Technology and Design (SUTD) forskere har afsløret, hvordan miljøet kan påvirke meget følsom kvanteadfærd som lokalisering. Deres fund, udgivet i
- Sådan bruges en Bushnell Reflector Telescope
- Hvad er de tre vigtigste sammenkoblede geokemiske cyklusser af Jorden.?
- Fire frygtet døde efter tyfonen ramte Japan
- Hvad er forskydning med hensyn til en bølge?
- Hvordan indeholder du elektricitet?
- Astrofysikere simulerer mikroskopiske klynger fra Big Bang


