Hvorfor reagerer små partikler hurtigere end store?
1. Overfladeareal:
* mindre partikler har et højere forhold mellem overfladeareal og volumen. Forestil dig en terning. Hvis du skærer den i halvdelen, har du to mindre terninger med det samme samlede volumen, men nu er der mere overflade udsat.
* reaktioner forekommer på overfladen. Jo mere overfladeareal en partikel har, jo flere steder er der for, at reaktioner kan forekomme. Dette øger hyppigheden af kollisioner mellem reaktanter og fremskynder reaktionen.
2. Diffusion:
* mindre partikler diffunderer hurtigere. Diffusion er bevægelsen af partikler fra et højt koncentrationsområde til et lavt koncentrationsområde. Mindre partikler oplever mindre modstand mod deres bevægelse, så de kan bevæge sig hurtigere og kollidere med reaktanter oftere.
3. Koncentrationsgradient:
* mindre partikler skaber stejlere koncentrationsgradienter. En koncentrationsgradient er forskellen i koncentration mellem to områder. Mindre partikler kan skabe stejlere gradienter, fordi de har et højere overfladeareal og volumenforhold, hvilket fører til en hurtigere bevægelse af reaktanter mod reaktionsstedet.
4. Tilgængelighed:
* reaktanter kan lettere adgang til det indre af små partikler. I store partikler kan reaktanter muligvis køre gennem mange lag for at nå reaktionsstedet og bremse reaktionen. Mindre partikler giver mulighed for mere direkte adgang til reaktionsstederne.
Eksempel:
Tænk på et stykke træforbrænding. Et lille stykke træ brænder meget hurtigere end en stor bjælke. Det mindre stykke har mere overfladeareal udsat for ilt, og flammerne kan trænge lettere ind, hvilket fører til en hurtigere reaktion.
Kortfattet:
Mindre partikler reagerer hurtigere end store, fordi de har et højere overfladeareal, diffus hurtigere, skaber stejlere koncentrationsgradienter og giver mulighed for lettere adgang til reaktionsstederne. Dette resulterer i hyppigere kollisioner mellem reaktanter og en hurtigere reaktionshastighed.
Sidste artikelHvad er 80 celsius i Fahrenheit?
Næste artikelHvorfor er kraftfelter nødvendige for at beskrive tyngdekraften?
 Varme artikler
Varme artikler
-
 Digitale kvantesimulatorer kan være forbavsende robusteKredit:CC0 Public Domain Ved løsning af kvantefysiske problemer i mange kropssystemer, såsom forudsigelse af materialegenskaber, konventionelle computere når hurtigt grænserne for deres kapacitet.
Digitale kvantesimulatorer kan være forbavsende robusteKredit:CC0 Public Domain Ved løsning af kvantefysiske problemer i mange kropssystemer, såsom forudsigelse af materialegenskaber, konventionelle computere når hurtigt grænserne for deres kapacitet. -
 Forskere vender en magnetisk hukommelsescelle med en lyspuls ved rekordhastighedEn ændring, forskere foretog på enheden, var at bruge et gennemsigtigt elektrisk materiale kaldet indiumtinoxid til elektroden for at lade lys passere igennem den. Disse lag stables i en søjle med en
Forskere vender en magnetisk hukommelsescelle med en lyspuls ved rekordhastighedEn ændring, forskere foretog på enheden, var at bruge et gennemsigtigt elektrisk materiale kaldet indiumtinoxid til elektroden for at lade lys passere igennem den. Disse lag stables i en søjle med en -
 Risfysikere RAMBO afslører magnetiske fænomener, der er nyttige til kvantesimulering og sansningEn Rice University-ledet undersøgelse finder en unik form for afstembare og ultrastærke spin-spin-interaktioner i orthoferriter under et stærkt magnetfelt. Opdagelsen har implikationer for kvantesimul
Risfysikere RAMBO afslører magnetiske fænomener, der er nyttige til kvantesimulering og sansningEn Rice University-ledet undersøgelse finder en unik form for afstembare og ultrastærke spin-spin-interaktioner i orthoferriter under et stærkt magnetfelt. Opdagelsen har implikationer for kvantesimul -
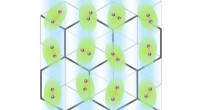 Ny 2D-superleder dannes ved højere temperaturer end nogensinde førSuperledende tilstand opdaget ved grænseflader med (111) orienterede KTaO3 overflader, som har et spændt honeycomb gitter. Cooper-elektronpar er vist i lilla. Transportmålinger tyder på, at den superl
Ny 2D-superleder dannes ved højere temperaturer end nogensinde førSuperledende tilstand opdaget ved grænseflader med (111) orienterede KTaO3 overflader, som har et spændt honeycomb gitter. Cooper-elektronpar er vist i lilla. Transportmålinger tyder på, at den superl
- Hvordan interagerer objekter med modsat ladning?
- Nanoprober rammer mål i tumorer, kunne mindske kemo-bivirkninger
- Lost and Hound:Videospil for synshæmmede
- Hvis væskens temperatur falder til 10 grader, ville Celsius alle have en tilsvarende ændring i vis…
- Hvordan illustrerer den endelige accept af pladetektonisk teori nogle aspekter videnskabelig metode?…
- Hvorfor alkoholproduktion fra biomasse energieffektiv?


