Hvad er en intermolekulekulær kraft?
Her er en sammenbrud:
hvad de gør:
* påvirker fysiske egenskaber: IMF'er bestemmer, hvor let et stof kan smelte, koge eller fordampe. De påvirker også et stofs viskositet (modstand mod flow) og dets evne til at opløses i andre stoffer.
* hold molekyler sammen: Selvom de ikke er så stærke som bindingerne inden for et molekyle, er IMF'er ansvarlige for at holde molekyler sammen i væsker og faste stoffer.
Typer af intermolekylære kræfter:
1. Hydrogenbinding: Den stærkeste type IMF, der forekommer, når et hydrogenatom er bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor. Disse bindinger skaber en stærk dipol-dipol-interaktion.
2. dipol-dipol-interaktioner: Forekommer mellem polære molekyler, der har permanente dipoler på grund af ujævn deling af elektroner.
3. London Dispersion Forces (LDFS): Til stede i alle molekyler, endda ikke -polære. De stammer fra midlertidige, inducerede dipoler, der forekommer på grund af bevægelsen af elektroner. LDF'er er generelt svagere end dipol-dipol-interaktioner.
4. ion-dipol-interaktioner: Forekommer mellem et ion og et polært molekyle. Disse interaktioner er vigtige i opløsninger, hvor salte opløses i polære opløsningsmidler som vand.
Nøglepunkter:
* styrke: Styrken af IMF'er øges generelt med stigende polaritet og faldende afstand mellem molekyler.
* kogepunkt: Stoffer med stærkere IMF'er har højere kogepunkter, fordi der kræves mere energi for at overvinde kræfterne, der holder molekylerne sammen.
* opløselighed: Lignende IMF'er mellem opløst stof og opløsningsmiddelmolekyler fremmer opløselighed. For eksempel opløses polære stoffer godt i polære opløsningsmidler på grund af brintbindingsinteraktioner.
Eksempler:
* Vand: Hydrogenbinding er den primære IMF i vand, hvilket fører til dets relativt høje kogepunkt og dets evne til at opløse mange polære forbindelser.
* methan (CH4): Metan er ikke -polær, så dens eneste IMF'er er svage London -spredningskræfter. Dette forklarer dets lave kogepunkt.
At forstå intermolekylære kræfter er afgørende for at forklare mange fysiske egenskaber ved stof og for at forudsige, hvordan stoffer vil opføre sig i forskellige miljøer.
Sidste artikelHvad er fusion i fysik?
Næste artikelHvad er afstand mellem 2 point videnskab?
 Varme artikler
Varme artikler
-
 Quadruple fusion imaging via transparent ultralydstransducerEt skematisk diagram over et firdobbelt fusionsbilleddannelsessystem udviklet ved koaksial kombination af en laser og en gennemsigtig ultralydstransducer. 1) Ultralydsbillede, 2) Fotoakustisk billede,
Quadruple fusion imaging via transparent ultralydstransducerEt skematisk diagram over et firdobbelt fusionsbilleddannelsessystem udviklet ved koaksial kombination af en laser og en gennemsigtig ultralydstransducer. 1) Ultralydsbillede, 2) Fotoakustisk billede, -
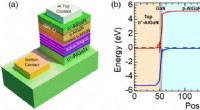 Højeffektive ultraviolette lysdioder til sterilisering af patogener, inklusive COVID-19Fig. 1. (a) Skematisk illustration af tunnelforbindelsens LED-strukturer. (b) Simuleret ligevægtsbånddiagram for en repræsentativ LED ved hjælp af et 5 nm GaN-lag i tunnelforbindelsen. De forskellige
Højeffektive ultraviolette lysdioder til sterilisering af patogener, inklusive COVID-19Fig. 1. (a) Skematisk illustration af tunnelforbindelsens LED-strukturer. (b) Simuleret ligevægtsbånddiagram for en repræsentativ LED ved hjælp af et 5 nm GaN-lag i tunnelforbindelsen. De forskellige -
 Undersøgelse:Vigtigt bidrag til spintronics har kun haft lidt overvejelser indtil nuKredit:CC0 Public Domain Elektronernes bevægelse kan have en betydeligt større indflydelse på spintroniske effekter end tidligere antaget. Denne opdagelse blev gjort af et internationalt forskerte
Undersøgelse:Vigtigt bidrag til spintronics har kun haft lidt overvejelser indtil nuKredit:CC0 Public Domain Elektronernes bevægelse kan have en betydeligt større indflydelse på spintroniske effekter end tidligere antaget. Denne opdagelse blev gjort af et internationalt forskerte -
 Lab eksperimenter med pulserede ionstråler afslører strålingsskadeprocesser i siliciumLawrence Livermore videnskabsmand Joseph Wallace justerer mikrostråleåbningen på Rutherfords tilbagespredningsspektrometrisystem, som bruges til at karakterisere strålingsskader som funktion af dybden
Lab eksperimenter med pulserede ionstråler afslører strålingsskadeprocesser i siliciumLawrence Livermore videnskabsmand Joseph Wallace justerer mikrostråleåbningen på Rutherfords tilbagespredningsspektrometrisystem, som bruges til at karakterisere strålingsskader som funktion af dybden


