Hvorfor er faste stoffer i det væsentlige ukomprimerbare?
Her er en sammenbrud:
* Luk pakning: Partiklerne i et fast stof er arrangeret i en meget ordnet, krystallinsk struktur. Dette arrangement minimerer rummet mellem partikler, hvilket fører til meget høj densitet.
* Stærke intermolekylære kræfter: De stærke attraktive kræfter mellem partiklerne i et fast stof (som ioniske, kovalente eller metalliske bindinger) holder dem tæt bundet og modstå ændringer i volumen.
* begrænset fri plads: I modsætning til væsker og gasser har faste stoffer meget lidt fri plads mellem deres partikler. Denne mangel på fri plads gør det ekstremt vanskeligt at presse partiklerne tættere sammen.
Hvorfor er væsker og gasser komprimerbare?
* væsker: Mens væsker har stærkere intermolekylære kræfter end gasser, har de stadig en vis fri plads mellem deres molekyler. Dette rum giver mulighed for en vis komprimering.
* Gasser: Gasser har meget svage intermolekylære kræfter og store afstande mellem deres partikler. Dette muliggør betydelig komprimering, da partiklerne kan presses tættere sammen.
Kortfattet: Den tæt pakket struktur og stærke intermolekylære kræfter i faste stoffer gør dem meget modstandsdygtige over for komprimering. Derfor betragtes de som i det væsentlige ukomprimerbare.
 Varme artikler
Varme artikler
-
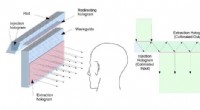 Holografi tilgang forbedrer heads up displays til fly og bilerDen nye heads-up display bruger holografiske optiske elementer til at injicere et billede i glasset, eller bølgeleder (til venstre). Lyset kommer ind i glasset og hopper frem og tilbage mellem dets fo
Holografi tilgang forbedrer heads up displays til fly og bilerDen nye heads-up display bruger holografiske optiske elementer til at injicere et billede i glasset, eller bølgeleder (til venstre). Lyset kommer ind i glasset og hopper frem og tilbage mellem dets fo -
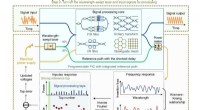 Verdens første selvkalibrerede fotoniske chip:En udveksling for optiske datamotorvejeKonceptuelt diagram af den selvkalibrerende integrerede bredbånds-PIC. Kredit:Xingyuan Xu et al., Nature Photonics (2022). DOI:10.1038/s41566-022-01020-z Forskning ledet af Monash og RMIT Universit
Verdens første selvkalibrerede fotoniske chip:En udveksling for optiske datamotorvejeKonceptuelt diagram af den selvkalibrerende integrerede bredbånds-PIC. Kredit:Xingyuan Xu et al., Nature Photonics (2022). DOI:10.1038/s41566-022-01020-z Forskning ledet af Monash og RMIT Universit -
 Er krokodil virkelig et kødædende zombidrug?Alya, 17, gennemgår behandling for afhængighed af stoffer, herunder heroin, krokodil, og andre hos City Without Drugs, et af de få lægemiddelbehandlingsfaciliteter i Rusland. Brendan Hoffman/Getty Ima
Er krokodil virkelig et kødædende zombidrug?Alya, 17, gennemgår behandling for afhængighed af stoffer, herunder heroin, krokodil, og andre hos City Without Drugs, et af de få lægemiddelbehandlingsfaciliteter i Rusland. Brendan Hoffman/Getty Ima -
 Forskere opdager en sammenhæng mellem superledning og det periodiske systemTOC graf. Kredit:Dmitrii V. Semenok et al./ The Journal of Physical Chemistry Letters Forskere fra Moskva Institut for Fysik og Teknologi og Skoltech har demonstreret aktiniumhydriders højtemper
Forskere opdager en sammenhæng mellem superledning og det periodiske systemTOC graf. Kredit:Dmitrii V. Semenok et al./ The Journal of Physical Chemistry Letters Forskere fra Moskva Institut for Fysik og Teknologi og Skoltech har demonstreret aktiniumhydriders højtemper
- Hvor langt er stjernebilledet Kræften fra Jorden?
- Facebook siger klar historiefunktion klar i år
- Idaho lander nationens første International Dark Sky Reserve
- Hvilke oplysninger har du brug for for at finde en acceleration?
- Gymnasium uden fitnesscenter? Med teknologi, det fanger
- Dobbeltlinet hvid dværg binært detekteret af astronomer


