Hvordan måles Titratable Acidity
Syrer er opløsninger, der har en højere koncentration af H + ioner end OH-ioner. Dette måles i form af pH. Rent vand, der har en lige mængde af hver ion, har en pH på 7. Syrer har en pH-værdi på mindre end 7, mens baserne har en pH mellem 7 og 14. Titrering er en laboratorieprocedure, hvor meget præcist målte mængder af et kemikalie tilføjes til en løsning for at bestemme noget om dets sammensætning. Dette eksperiment er stadig muligt uden en præcis skala og volumetrisk glasvarer, men resultaterne vil være mindre præcise.
Standardiser NaOH Solution
For at bestemme, hvor sur mysteriet er, vil du Tilsæt NaOH, en base, drop-by-drop, indtil syren er neutraliseret. Dette er kun nyttigt, hvis du kender den nøjagtige koncentration af din NaOH. Hvis du allerede kender den præcise molaritet af din NaOH, skal du springe over denne sektion. Ellers skal du bruge din skala, som forhåbentlig kan måle til hundrede eller tusindedel af et gram og veje 0,5 gram KHP. Bare rolig, hvis du ikke kan få præcis 0,500 gram - skriv bare ned den egentlige vægt.
Hæld KHP'en i et bægerglas, og opløs det i vand. Det er ligegyldigt, hvor meget vand du bruger, så længe hele KHP er opløst.
Opsæt din buret. En buret er et langt glasrør, der generelt er markeret ved hver tiendedel af en milliliter, åben i den ene ende med en ventil på den anden. Fyld buret med NaOH-opløsningen, og læg den over KHP-bægeret med bundventilen lukket. Skriv ned lydstyrken.
Tilføj et par dråber af din indikator, og begynd at titrere. Tilsæt NaOH, indtil du begynder at se blå eller lyserød farve i bægeret, afhængigt af hvilken indikator du brugte. Gå meget langsomt fra dette punkt og tilføj kun en dråbe eller to ad gangen og omrør derefter opløsningen. Når farven forbliver konstant og ikke falmer tilbage for at rydde efter omrøring, er titreringen fuldstændig. Marker det sidste volumen, og træk det derefter fra startvolumenet for at bestemme titreringsvolumenet.
Beregn molariteten af NaOH. Ved titreringsendepunktet er molene syre (KHP) lig med molene af base (NaOH). Beregn mol KHP ved at dividere den mængde, du vejede ud af molekylvægten af KHP, hvilket er 204,2212 g /mol. Hvis du vejer 0,500 gram, kommer dette til 0,00245 mol. Molariteten er lig med mol pr. Liter. Hvis du brugte 50 ml NaOH eller 0,05 liter, divider du derefter 0,00245 med 0,05 for at opnå molariteten af NaOH: 0,049 M.
Titrering af den ukendte prøve
Du skal stadig have mange af frisk NaOH tilbage. Fyld buret igen, og marker lydstyrken. Med så stor præcision som dit udstyr tillader, måle en bestemt mængde af din ukendte prøve i et bægerglas. Mellem 50 og 100 ml skal fungere.
Tilføj to eller tre dråber indikator til bægeret og læg det under buret. Begynd titreringen. Du kan først gå hurtigere, hvirvle bægeret med en hånd for at blande opløsningen, men sænk, når farven begynder at dukke op. Tilsæt NaOH en dråbe ad gangen, indtil hele bægeret ændrer farve. Marker mængden af NaOH fra buret og trækker fra det oprindelige volumen.
Beregn hvor mange mol NaOH du har tilsat. Du må simpelthen multiplicere den molaritet du har beregnet (0,049 M i eksemplet) med det volumen der er tilføjet fra buret. Sørg for at konvertere til liter i stedet for milliliter. Hvis du for eksempel har tilsat 100 ml, vil de totale mol tilsat være 0,0049. Dette tal er lig med antallet af syre i din ukendte løsning. Du kan yderligere beregne koncentrationen eller molariteten af dit ukendte ved at dividere dette tal med det antal liter, du lægger i bægeret i trin 1.
Tip
For mere præcision udfør standardiseringen af NaOH titrering mindst tre gange og gennemsnittet resultaterne. Gør det samme for titrering af din mystiske prøve.
Advarsel
Hvert kemikalie i dette forsøg, med undtagelse af indikatorerne, er potentielt skadeligt. Hvis du får noget NaOH, KHP eller syre på dine hænder eller i øjnene, skal du skylle grundigt under rindende vand. Sørg for at rydde op eventuelle spild, fordi fordampning kan efterlade en stærkt koncentreret rest på bordet.
Sidste artikelHvordan virker PH papir?
Næste artikelSådan beregnes en temperatur Gradient
 Varme artikler
Varme artikler
-
 Hvad er en kovalent obligation?Er du god til at dele med andre? Så er du muligvis kovalent, som i atombindinger. Der er to typer atombindinger, der kan danne et molekyle eller en forbindelse, der binder dem sammen. En kovalent bind
Hvad er en kovalent obligation?Er du god til at dele med andre? Så er du muligvis kovalent, som i atombindinger. Der er to typer atombindinger, der kan danne et molekyle eller en forbindelse, der binder dem sammen. En kovalent bind -
 Sådan kombineres kemiske ligningerKemiske ligninger definerer, hvordan specifikke kemikalier interagerer og reagerer med hinanden. Ved enkle reaktioner er den kemiske ligning en enkelt proces, men der forekommer mange komplekse reakti
Sådan kombineres kemiske ligningerKemiske ligninger definerer, hvordan specifikke kemikalier interagerer og reagerer med hinanden. Ved enkle reaktioner er den kemiske ligning en enkelt proces, men der forekommer mange komplekse reakti -
 Sådan beregnes fordampningsraterVand og andre væsker fordampes med forskellige hastigheder. Disse hastigheder påvirkes af temperaturen, fugtigheden, luftstrømmen og overfladearealet af væsken, der udsættes for luften. Mens en væs
Sådan beregnes fordampningsraterVand og andre væsker fordampes med forskellige hastigheder. Disse hastigheder påvirkes af temperaturen, fugtigheden, luftstrømmen og overfladearealet af væsken, der udsættes for luften. Mens en væs -
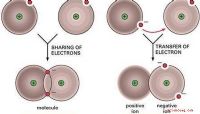 Definition af molekylære obligationerEn molekylær eller kovalent binding dannes, når atomer binder sig ved at dele par elektroner. Denne deling kan ske fra atom til atom eller fra et atom til en anden molekylær binding. Typer Det e
Definition af molekylære obligationerEn molekylær eller kovalent binding dannes, når atomer binder sig ved at dele par elektroner. Denne deling kan ske fra atom til atom eller fra et atom til en anden molekylær binding. Typer Det e


