Hvad er sammenligningen mellem atomer og molekyler?
Fysisk materiale består af atomer og molekyler. Et atom er underkomponenten af et molekyle eller den mindste enhed af materie. Det er den mindste del et element kan opdele i. Et molekyle består af atomer, der er bundet af ionisk, kovalent eller metallisk binding.
Egenskaber
Et atom eksisterer enten som en neutral komponent (med lige mange protoner og elektroner) eller som en ion (en positiv ion har et større antal protoner end elektroner, og en negativ ion har flere elektroner end protoner. Antallet af protoner i et atom kaldes dets atomnummer (Z), og antallet af neutroner i et atom kaldes dets neutronnummer (N). Massens tal (A) er summen af protoner og neutroner (Z + N). Et molekyle er neutralt ladet og findes i et af to tilstande: Stabilt eller ustabilt. Dens masse kan være beregnes ud fra dens molekylære formel.
Komponenter
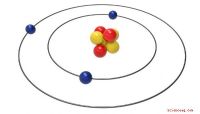
Et atom består af subatomære partikler (elektron, neutron og proton), en kerne- og elektronsky. Elektroner er negativt ladede partikler, der ligger i en elektron sky, der drejer rundt om den centrale kerne. En elektrons masse er ca. 0,0005 gange den for en pro ton. Protoner er positivt ladede partikler, der ligger inden for en atomkerne. En kerne er en neutral partikel, der tegner sig for næsten 99,9 procent af atomens samlede masse. Et molekyle består af to eller flere atomer, der holdes sammen af en stærk kemisk binding.
Størrelse
Et atom er ca. 0,2 nanometer i diameter. Et nanometer svarer til 0.0000000001 meter. Det mindste molekyle i naturen er det diatomiske hydrogenmolekyle (H2), som er 0,74 Ångstrøm. En angstrøm er lig med 0,1 nanometer eller 1,0 x 10-10 meter.
Form
Atomer har ingen fast form og eksisterer som ringe, lober eller kugler. Formen af et molekyle afhænger af arrangementet af dets bestanddele. Molekyler kan være lineære, trigonale plane, tetrahedrale, trigonale pyramidale, trigonale bipyramidale og oktaediske, afhængigt af deres atommæssige sammensætning. Et diatomisk molekyle er lineært i form, mens et molekyle lavet af tre bindingspar (BF3) er trigonalt plan med sine FBF-bindinger 120 grader til hinanden.
Typer
Der er mange typer af atomer, hver med en anden størrelse, molekylvægt og navn. Eksempler på almindelige atomer indbefatter hydrogenatom, svovlatom, oxygenatom og nitrogenatom. De forskellige typer af molekyler indbefatter: diatomiske, homoatomiske og hetroatomiske molekyler. Et diatomisk molekyle består af to atomer; et homoatomisk molekyle består af to (eller flere) atomer af samme element (eller stof); og et hetroatomisk molekyle består af to eller flere atomer af forskellige elementer. Ifølge "Fundamentals for Chemistry" er molekyler enten simple og komplekse. Enkle molekyler består af et enkelt atom, mens komplekse molekyler består af to eller flere atomer.
Sidste artikelOne Day Science Fair Project Ideas
Næste artikelTitration Explained
 Varme artikler
Varme artikler
-
 Eksempler på fordampning og kondensationKondensation og fordampning er to processer, hvorved stof ændrer fase. Kondensation er overgangen fra en gasfase til en flydende eller fast fase. Fordampning er på den anden side overgangen fra væske
Eksempler på fordampning og kondensationKondensation og fordampning er to processer, hvorved stof ændrer fase. Kondensation er overgangen fra en gasfase til en flydende eller fast fase. Fordampning er på den anden side overgangen fra væske -
 Sådan beregnes polymerisationsgradenEn polymerisationsgrad er en nøglekarakteristik for polymerer, der bestemmer fysiske egenskaber for polymermaterialer. Polymerer er store molekyler, der består af gentagne strukturelle (monomere) enhe
Sådan beregnes polymerisationsgradenEn polymerisationsgrad er en nøglekarakteristik for polymerer, der bestemmer fysiske egenskaber for polymermaterialer. Polymerer er store molekyler, der består af gentagne strukturelle (monomere) enhe -
 Sådan konverteres Joules til KelvinForskellen mellem varme og temperatur kan være et vanskeligt begreb at forstå. I det væsentlige er varme den samlede mængde kinetisk energi, som molekylerne i et stof har, og måles i joules enheder
Sådan konverteres Joules til KelvinForskellen mellem varme og temperatur kan være et vanskeligt begreb at forstå. I det væsentlige er varme den samlede mængde kinetisk energi, som molekylerne i et stof har, og måles i joules enheder -
 Sådan beregnes mængden af reaktant i ExcessOverskydende reaktant, også kendt som overskydende reagens, er den mængde kemisk, der er tilbage efter en afsluttet reaktion. Det styres af den anden reaktant, der bruges fuldstændigt og derfor ikke k
Sådan beregnes mængden af reaktant i ExcessOverskydende reaktant, også kendt som overskydende reagens, er den mængde kemisk, der er tilbage efter en afsluttet reaktion. Det styres af den anden reaktant, der bruges fuldstændigt og derfor ikke k


