EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidler
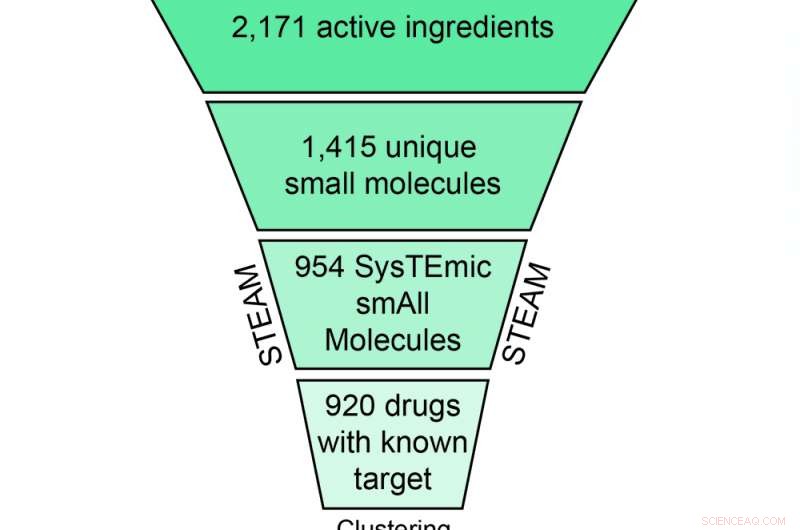
Skematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek
CeMM Library of Unique Drugs (CLOUD) er det første kondenserede sæt af FDA-godkendte lægemidler, der repræsenterer alle kliniske forbindelser. Dets potentiale blev vist i en kombinatorisk skærm med høj kapacitet på CeMM kemisk screeningsplatform, udgivet i Naturens kemiske biologi :ved at teste alle CLOUD-forbindelser i kombination med hinanden, et par hidtil ubeslægtede lægemidler viste sig at være yderst effektive mod flere prostatacancercellelinjer kendt for deres modstandsdygtighed over for terapi.
To lægemidler taget sammen kan nogle gange føre til resultater, der i vid udstrækning afviger fra virkningen af de adskilte forbindelser - en kendsgerning, der er velkendt fra advarsler på indlægssedler. Imidlertid, mens læger på det kraftigste fraråder blanding af lægemidler uden opsyn, synergien mellem to kombinerede lægemidler vurderet i eksperimentelle omgivelser kan afsløre helt nye terapeutiske muligheder. Alligevel, at finde en ny kombination af lægemidler til en given sygdom inden for de mere end 30, 000 lægemiddelprodukter godkendt af tilsynsmyndighederne var hidtil en stor udfordring for videnskabsmænd.
For at lette systematisk screening for synergistiske interaktioner mellem lægemidler, CeMM PI Stefan Kubicek og hans kolleger etablerede en samling af 308 forbindelser (CeMM Library of Unique Drugs, CLOUD), der effektivt repræsenterer mangfoldigheden af strukturer og molekylære mål for alle FDA-godkendte kemiske enheder. I øvrigt, forskerne beviste CLOUD's potentiale med CeMMs stærkt automatiserede kemiske screeningsplatform ved at identificere en ny synergistisk effekt af to lægemidler (flutamid og phenprocoumon (PPC)) på prostatacancerceller. Resultaterne af Kubiceks team med Marco Licciardello som første forfatter blev offentliggjort i Naturens kemiske biologi .
Til etablering af CLOUD, en smart serie af kondenseringstrin var nødvendig:CeMM-forskerne bestemte og udtog først 2171 unikke aktive farmaceutiske ingredienser fra databasen, kassere alle produkter med identiske forbindelser. Næste, de fjernede store makromolekyler som antistoffer såvel som saltfragmenter, og kasserede alle molekyler, der udøver deres biologiske virkninger gennem andre mekanismer end protein-ligand-interaktioner, ikke bruges til behandling af sygdomme eller findes kun i aktuelle produkter.
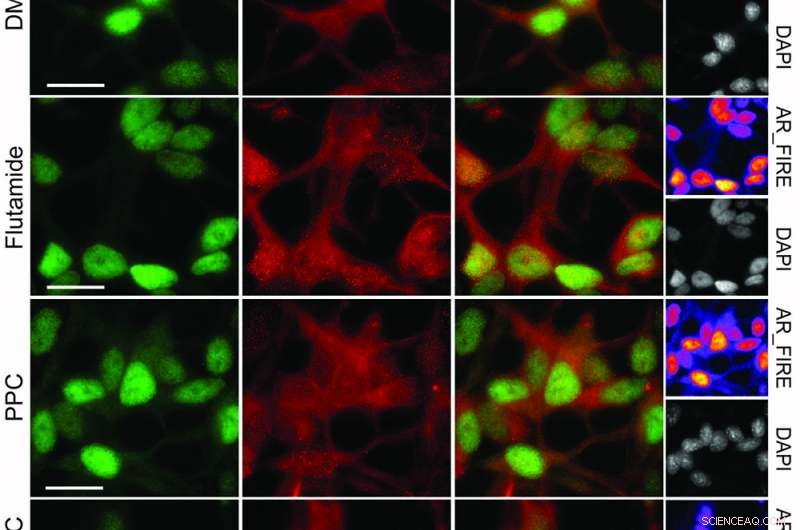
Immunfluorescensanalyse af prostatacancerceller behandlet med 15 mM flutamid, 35 μM PPC eller kombinationen i 24 timer. Skala Bar 20 μM. Kredit:© Nature Chemical Biology / Stefan Kubicek
Med de resterende 954 systemisk aktive små molekyler (STEAM samling), arbejdet var lige begyndt:for at skabe en omfattende samling af forbindelser, der passer på en standard 384-brønds screeningsplade, forskerne tilføjede biologiske aktiviteter til alle lægemidler med kendte molekylære mål og grupperede dem i 176 klasser med lignende struktur og aktivitet. Med en sofistikeret klyngealgoritme, 239 repræsentative lægemidler blev udvalgt fra disse klasser. Kombineret med 34 lægemidler med ukendt mål og 35 aktive former for prodrugs (som ellers skal metaboliseres for at blive aktive), 308 forbindelser blev udvalgt i alt til CLOUD - verdens første bibliotek, der repræsenterer alle FDA-godkendte kemiske enheder inklusive den aktive form af prodrugs.
For at afprøve den kombinatoriske skærm med CLOUD, Kubiceks gruppe undersøgte effekten af parvise kombinationer af CLOUD-forbindelser på levedygtigheden på KBM7 leukæmiceller, en cellelinje velegnet til lægemiddelforsøg. Ved hjælp af en dosis valgt for hver forbindelse individuelt baseret på den klinisk relevante maksimale plasmakoncentration, forskerne fandt en stærk synergistisk interaktion mellem flutamid, et lægemiddel godkendt til behandling af prostatacancer, og phenprocoumon (PPC), en anti-tromboseforbindelse. I kombination, flutamid og PPC dræbte effektivt kræftcellerne.
Efter at have identificeret androgenreceptoren (AR) som molekylært mål for den synergistiske interaktion, forskerne prøvede lægemiddelkombinationen på prostatacancerceller, der vides at være svære at behandle - og ramte øjet. "Kombinationen inducerede massiv celledød i prostatacancerceller. Vi gik derefter tilbage til hele listen over godkendte lægemidler, og sandelig, vi kunne vise, at alle lægemidler fra de klynger, som flutamid og phenprocoumon repræsenterer, synergi. Derved validerede vi det reduktionistiske koncept, der ligger til grund for CLOUD-biblioteket, " forklarer Stefan Kubicek.
Med deres eksperimenter, Kubiceks team i samarbejde med forskere fra det medicinske universitet i Wien, Uppsala Universitet, Enamine Kiev og Max Planck Instituttet for Informatik i Saarbrücken beviste, at CLOUD er det ideelle sæt af forbindelser til at udvikle screeningsassays og opdage nye applikationer for godkendte aktive ingredienser. På CeMM, en række vigtige opdagelser om nye ansøgninger om godkendte lægemidler er allerede blevet gjort med CLOUD. Desuden, som vist i det aktuelle nummer af Naturens kemiske biologi , CLOUD er ideel til at finde nye lægemiddelkombinationer. "I betragtning af disse succeser, Jeg vil forudsige, at dette sæt af forbindelser vil blive verdensstandard for alle screeningskampagner", understreger Stefan Kubicek.
Sidste artikelVideo:Skal du tisse på et vandmandsstik?
Næste artikelHvordan guld kan genbruge biobrændstofaffald til nyttigt additiv
 Varme artikler
Varme artikler
-
 Plastforurening:Kemisk genanvendelse kunne give en løsningKredit:Salvacampillo/Shutterstock Verden drukner i plastik. Omkring 60 % af de mere end 8, 700 millioner tons plastik, der nogensinde er fremstillet, er ikke længere i brug, i stedet sad mest på l
Plastforurening:Kemisk genanvendelse kunne give en løsningKredit:Salvacampillo/Shutterstock Verden drukner i plastik. Omkring 60 % af de mere end 8, 700 millioner tons plastik, der nogensinde er fremstillet, er ikke længere i brug, i stedet sad mest på l -
 Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove
Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove -
 Undersøgelse afslører en simpel kemisk proces, der kan have ført til livets oprindelse på JordenEt vådt-tørt scenarie i en præbiotisk varm kilde eller tidevandspool. A) viser poolen med de fem slags alfa-hydroxysyrer, der blev brugt i denne undersøgelse. B) viser tørrebassinet, hvor et bibliotek
Undersøgelse afslører en simpel kemisk proces, der kan have ført til livets oprindelse på JordenEt vådt-tørt scenarie i en præbiotisk varm kilde eller tidevandspool. A) viser poolen med de fem slags alfa-hydroxysyrer, der blev brugt i denne undersøgelse. B) viser tørrebassinet, hvor et bibliotek -
 Ny indsigt i strukturen af et dræberproteinStephanie Bleicken (til venstre), Enrica Bordignon, og Tufa Assafa undersøgte proteinet ved hjælp af forskellige spektroskopiske teknikker. Kredit:RUB, Kramer Forskere ved Ruhr-Universität Bochum
Ny indsigt i strukturen af et dræberproteinStephanie Bleicken (til venstre), Enrica Bordignon, og Tufa Assafa undersøgte proteinet ved hjælp af forskellige spektroskopiske teknikker. Kredit:RUB, Kramer Forskere ved Ruhr-Universität Bochum
- Zombiestormen Leslie smadrer ind i Portugal
- Sådan laver du krystaller med Epsom Salt
- Undersøgelse kaster mere lys over egenskaberne af røntgenpulsaren XTE J1858+034
- Cyberkriminalitet:Internettet udhuler teenage-impulskontrol
- Undersøg først for at vise, hvordan par bruger tid minut for minut
- Velstand dræber planeten, advarer forskere


