Rosetta Stone-protein tilbyder en ny mekanisme for allosteri
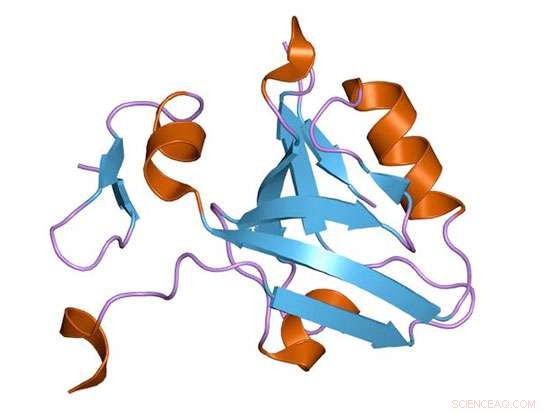
En proteintegneserie af et PDZ-domæne fra det synaptiske protein PSD-95. Kredit:Wikimedia Commons
Årevis, et uløst problem nagede ved University of Alabama i Birmingham forsker Chad Petit, Ph.d. Det involverede et vigtigt biologisk fænomen kaldet allosteri, en fundamental metode til enzymregulering, der er afgørende i levende celler.
I allosteri, en ligand binder til en del af enzymet, og at binding enten tænder eller slukker for enzymets aktive sted. Da det ligandbindingssted og det aktive sted er placeret i forskellige dele af enzymet, der skal være en eller anden biofysisk mekanisme, der forbinder de to ændringer.
Den første observation af, hvad der senere skulle blive kendt som allosteri, involverede hæmoglobin, proteinet, der transporterer ilt i blodet. Christian Bohr, for mere end et århundrede siden, fandt ud af, at tilstedeværelsen af kuldioxid ændrede hæmoglobins bindingsaffinitet for ilt.
Petit, nu en UAB-assistent professor i biokemi og molekylær genetik, havde arbejdet på UNC-Chapel Hill på et proteindomæne fra et større protein, der er vigtigt for nervesynapsefunktionen, sammen med den daværende kandidatstuderende Anthony "Tony" Law, M.D., Ph.d. Deres interesse var at forstå, hvordan energi kunne udbredes gennem et protein i fravær af nogen mærkbar ændring i strukturen.
I et banebrydende 2009 PNAS papir, Petit fandt ud af, at fjernelse af en lille del af proteindomænet-en alfa-spiralformet streng af aminosyrer-forårsagede et 25 gange fald i binding. Denne deletion var beregnet til at efterligne phosphorylering af PDZ3-domænet. Mekanismen, der blev bestemt til at drive dette fald, syntes at være globale ændringer i sidekædernes bevægelser uden nogen tilsyneladende ændring i strukturen af PDZ3-proteindomænet. Det var et af de første klare tilfælde af, hvad der ville blive betegnet som "dynamisk allosteri."
Men der var et paradoks, et ubesvaret spørgsmål, der nagede Petit, selv efter han var gået over til at studere et influenzaprotein på UAB. Det alfa-helix-deletionsprotein var 10 procent mindre end det native PDZ3, så det burde være tumlet hurtigere end det native protein. Men biofysiske forsøg viste, at det havde en næsten identisk tumblinghastighed sammenlignet med native PDZ3.
I årenes løb, Petit og Law, som nu er kirurgisk bosiddende i otolaryngologi ved University of Washington School of Medicine, blev ved med at vende tilbage til dette puslespil. Endelig udklækkede de en kættersk idé - den uventede tumlingshastighed må skyldes et øget volumen af det mindre protein.
"Så, vi begyndte at planlægge eksperimenter, "Petit sagde." Vi startede med en observation, vi lavede en hypotese, og så brugte vi år på at teste den hypotese."
Hvert hjørne vi kiggede ind i støttede den hypotese, " sagde Petit. "Dette var ren videnskab - det er den reneste videnskab, jeg nogensinde har lavet."
Ved hjælp af en grebspose med biofysiske eksperimenter med uhåndterlige navne som HSQC -spektre, NOESY analyse, differentiel scanning kalorimetri isotermer, småvinklet røntgenspredning og spinafspænding, samt eksperimenter i nærvær af opløsningsmidler, der fungerer som stabiliserende eller destabiliserende osmolytter, Petit, Law og deres forskerkolleger kom til følgende konklusion - alfa-helix-deletionsproteinet var faktisk udvidet i størrelse, og det var faktisk større i volumen end det native PDZ3-protein. Yderligere, denne afslappede størrelse fandt sted uden nogen mærkbar ændring i proteinstruktur.
Det større volumen deletionsprotein viste alle de normale karakteristika for det mere tætpakkede native protein, og det kunne eksperimentelt komprimeres gennem temperaturændringer eller stabiliserende osmolytter.
Som Petit, Law og deres kolleger undersøgte litteraturen, de så, at folk havde set spor af sådan en ny allosterisk mekanisme for så mange som 35 år siden, og forskellige papirer gav en generel fornemmelse af, at det kan forekomme i andre proteiner eller enzymer.
Denne opdagelse - i det mindste inden for biofysik og kemi - var et ret stort sprøjt.
Deres papir blev accepteret af Journal of the American Chemical Society , som har en effektfaktor på 13, og de blev bedt om at lave forsideillustrationen. Avisen blev omtalt i tidsskriftets JAC Spotlight, og det blev også udvalgt af fakultetet på 1000, en gruppe på 8, 000 seniorforskere, der anbefaler de vigtigste forskningsartikler inden for biologi og medicin.
Som Petit og kolleger skrev i deres papir, "Den uventede observation, at funktion kan udledes af udvidet, lavdensitetsproteintilstande har brede implikationer for vores forståelse af allosteri og foreslår, at det generelle koncept for den native tilstand udvides for at tillade mere variable fysiske dimensioner med løsere pakning."
"Det er det bedste papir, jeg har skrevet, " sagde Petit. "Uanset hvilken grund, dette deletionsprotein tillod os at studere denne mekanisme. Tony kalder det vores Rosetta Stone."
 Varme artikler
Varme artikler
-
 Ny undersøgelse identificerer mulige forfædre til RNAHvilke molekyler dannede RNA, og kan vi bruge dem til at identificere, hvor der kan dannes liv i universet? Kredit:NASA/Jenny Mottar Forskere fra Georgia Institute of Technology har muligvis gjort
Ny undersøgelse identificerer mulige forfædre til RNAHvilke molekyler dannede RNA, og kan vi bruge dem til at identificere, hvor der kan dannes liv i universet? Kredit:NASA/Jenny Mottar Forskere fra Georgia Institute of Technology har muligvis gjort -
 Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle
Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle -
 Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll
Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll -
 TNT kan gå på pension efter 116 år på jobbetSprængstofkemiker David Chavez hælder et eksempel på smeltestøbt sprængstof i en kobberform ved Los Alamos National Laboratorys Technical Area 9. Kredit:LANL Forskere ved Los Alamos National Labor
TNT kan gå på pension efter 116 år på jobbetSprængstofkemiker David Chavez hælder et eksempel på smeltestøbt sprængstof i en kobberform ved Los Alamos National Laboratorys Technical Area 9. Kredit:LANL Forskere ved Los Alamos National Labor
- Incitamenter kunne vende omkostningerne ved biobrændstofmandater til miljømæssige fordele
- Hvordan overlever gigantpandaer?
- Gamle luftfotos kan hjælpe med at overvåge gletscherændringer, undersøgelse viser
- Putin banker firebrand for at stå i spidsen for et rumfartsagentur
- NASA indstillet til at lancere Dellingr; CubeSat er målrettet designet til at forbedre pålidelighe…
- Ny letvægts, bærbar robotdragt for at øge løbe- og gåydelsen


