Proteinblanding under blåt lys
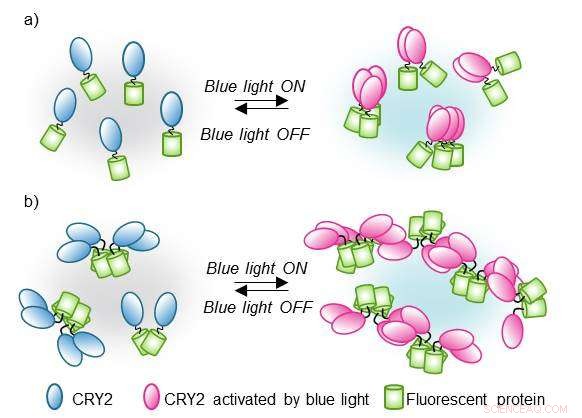
Skema af CRY2PHR klyngemekanismen udløst af blåt lys. I dette optogenetiske system, CRY2-klynger (blå og pink) styres reversibelt af blåt lys. Hvis CRY2 er forbundet med fluorescerende proteiner (grøn), clustering timing og funktioner kan visualiseres og måles ved konfokalmikroskop. Forskerne antager, at hvis de fluorescerende proteiner er præ-samlet i par eller små grupper (b), teknikken fører til større fluorescerende klynger. Kredit:Institut for Grundvidenskab
En af de nuværende udfordringer i biologi er at forstå hurtigt skiftende fænomener. Interessant nok, kun en lille del af dem skyldes proteiner, der virker isoleret, størstedelen af biologiske hændelser er reguleret af proteiner, der virker sammen i klynger. Forskere ved Center for Kognition og Socialitet, inden for Institut for Grundvidenskab (IBS), har udviklet et nyt værktøj, kaldet "CRY2clust", at udløse proteinklyngedannelse som reaktion på blåt lys. Denne nye teknik har en meget hurtigere responsrate og højere lysfølsomhed end eksisterende metoder. Udgivet i Naturkommunikation , dette nye værktøj kunne fremme vores forståelse af utallige molekylære og cellulære mekanismer.
CRY2clust er baseret på et fotoreceptorprotein kaldet cryptochrome 2 (CRY2), stammer fra planten Arabidopsis thaliana. CRY2 medierer plantevækst og udvikling, og mere specifikt, en del af CRY2, kendt som CRY2 Photolyase Homology Region (CRY2PHR), får dette protein til at samle sig som reaktion på den blå del af sollyset.
CRY2PHRs funktioner har allerede tiltrukket sig videnskabsmænds opmærksomhed, hvem gjorde det til et værktøj til optogenetik, en innovativ teknik baseret på biologi og optik, der tillader kunstig kontrol af biologiske hændelser med laserlys. Takket være optogenetik, veldefinerede cellulære aktiviteter kan nemt slås til og fra på bestemte steder og tidspunkter. For eksempel, protein af interesse bundet til CRY2PHR samles i nærvær af blåt lys og skilles ad, når lyset slukkes, resulterer i forskellige biologiske effekter. Imidlertid, videnskabsmænd har rapporteret, at effektiviteten af dette system varierer dramatisk afhængigt af typen af målproteiner bundet til CRY2PHR, begrænser dets brug. IBS-teamet har søgt at forbedre det:"CRY2's 3D-struktur er ikke blevet defineret endnu, så vi har prøvet forskellige strategier for at forstå, hvordan det fungerer inde i celler og for at gøre det mere effektivt, " forklarer KIM Na Yeon, en ph.d.-studerende i teamet.
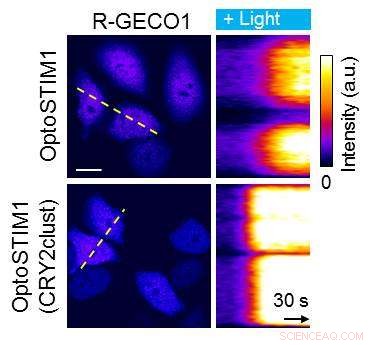
Sammenligning af den originale OPTOSTIM1 (med CRY2PHR) og OPTOSTIM1 med den nye CRY2clust. I dette eksperiment, enten CRY2PHR eller den nyudviklede CRY2clust var bundet til et protein, der regulerer åbningen af calciumkanaler på cellen. Blåt lys inducerer denne calciumkanalregulator til at klynge sig sammen og som følge heraf åbnes calciumkanaler. Analysen af cellernes calciumindtag viste, at den nye CRY2clust er hurtigere dobbelt. Højere intensitet (gul-hvid) betyder, at der kom mere calcium ind i cellen.
Det nye optogenetiske værktøj udviklet af IBS-forskere, CRY2-klynge, består af CRY2PHR plus 9 aminosyrerester, som er udviklet til at maksimere dens ydeevne. I sammenligning med andre CRY2-afledte optogenetiske systemer, såsom CRY2olig, CRY2clust udløser hurtigere proteinassociering og dissociation, når lyset tændes og slukkes, henholdsvis. Den er funktionel ved lavere blå lysintensitet (90 mikrowatt/mm2). I øvrigt, da det ikke akkumuleres i nukleare strukturer, kaldet nukleare pletter, det kan være nyttigt at studere nukleare processer.
Holdet anvendte CRY2clust med succes på to tilgængelige optogenetiske værktøjer:OptoSTIM1 og Raf1. I 2015 det samme IBS forskningscenter skabte en lysstyret regulator af calciumkanaler, OptoSTIM1, og brugte det til at forbedre musens hukommelse. I begge tilfælde at erstatte CRY2PHR med CRY2clust øgede systemernes hastighed og ydeevne.
"Vi har præsenteret et nyt dynamisk optogenetisk værktøj til at studere protein homo-oligodimerisering, det er klyngedannelse, som kunne være nyttigt for biologens værktøjskasse, " konkluderer prof. HEO Won Do, den førende forfatter til denne undersøgelse. Holdet arbejder nu på at udvikle nye optogenetiske systemer til brug i neurovidenskab.
 Varme artikler
Varme artikler
-
 Forskere udvikler tillandsia-inspirerede hygroskopiske fototermiske organogeler til atmosfærisk van…Kredit:CC0 Public Domain Som en typisk repræsentant for luftværker, Tillandsia -arter kan absorbere fugt fra luften med deres blade. Inspireret af dette hygroskopiske løv, Prof. Chen Taos team ved
Forskere udvikler tillandsia-inspirerede hygroskopiske fototermiske organogeler til atmosfærisk van…Kredit:CC0 Public Domain Som en typisk repræsentant for luftværker, Tillandsia -arter kan absorbere fugt fra luften med deres blade. Inspireret af dette hygroskopiske løv, Prof. Chen Taos team ved -
 Salt tager et hurtigt skridt, før det falder ud af vandetI et fund med konsekvenser for emner, herunder klimamodeller og lægemiddelproduktion, beregningsmæssig forskning fra Princeton University har beskrevet et yderligere trin i udfældningen af saltkryst
Salt tager et hurtigt skridt, før det falder ud af vandetI et fund med konsekvenser for emner, herunder klimamodeller og lægemiddelproduktion, beregningsmæssig forskning fra Princeton University har beskrevet et yderligere trin i udfældningen af saltkryst -
 Videnskabseksperimenter på en kartoffels osmoseOsmose, processen i hvilken opløsningsmiddelmolekyler bevæger sig fra et område med lavere opløsningsmiddelkoncentration til et område med højere opløsningsmiddelkoncentration, kan let demonstreres me
Videnskabseksperimenter på en kartoffels osmoseOsmose, processen i hvilken opløsningsmiddelmolekyler bevæger sig fra et område med lavere opløsningsmiddelkoncentration til et område med højere opløsningsmiddelkoncentration, kan let demonstreres me -
 Forskere bruger kulstof nanorør-teknologi til at udvikle robuste vandafsaltningsmembranerSEM-billeder af MWCNT-PA (Multi-Walled Carbon Nanotube-Polyamide) nanokompositmembraner, for almindelig PA, og PA med 5, 9,5, 12,5, 15,5, 17 og 20 vægt% MWCNT, hvor de typiske laplignende strukturer o
Forskere bruger kulstof nanorør-teknologi til at udvikle robuste vandafsaltningsmembranerSEM-billeder af MWCNT-PA (Multi-Walled Carbon Nanotube-Polyamide) nanokompositmembraner, for almindelig PA, og PA med 5, 9,5, 12,5, 15,5, 17 og 20 vægt% MWCNT, hvor de typiske laplignende strukturer o
- Værste juni for Amazonas skovbrande i Brasilien siden 2007:data
- Amazon-undersøgelse viser, at mere end halvdelen af amerikanske arbejdere siger, at coronavirus h…
- Silicium nanotråde under ekstrem trækbelastning kan føre til mere effektive transistorer
- Hvordan bliver klimaet, når Jordens næste superkontinent dannes?
- Grafenbaseret sensor registrerer skadelig luftforurening i hjemmet
- WhatsApp forsøger at dæmme op for falske nyheder forud for valget i Pakistan


