Energetiske omkostninger ved den entatiske tilstand af cytochrom c kvantificeret
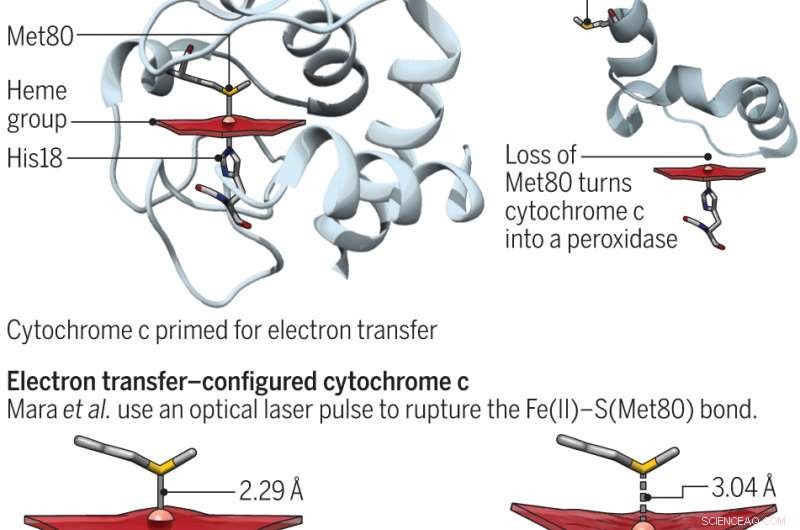
En ændring i det aktive steds konformation gør cytochrom c fra en elektronshuttle i respiration til et peroxidaseenzym til apoptose. Kredit:(c) Videnskab 23. juni 2017:Vol. 356, Udgave 6344, s. 1236, DOI:10.1126/science.aan5587
(Phys.org) – Et team af forskere ved Stanford University har brugt ultrahurtig røntgenabsorption og emissionsspektroskopi til at kvantificere den entatiske tilstand af cytokrom c. I deres papir offentliggjort i tidsskriftet Videnskab , gruppen skitserer deres procedure og hvad de har lært. Kara Bren og Emma Raven med henholdsvis University of Rochester og University of Leicester tilbyder et perspektiv på arbejdet udført af teamet i samme tidsskriftsudgave, og skitsere nogle af implikationerne vedrørende den rolle, som proteinet spiller i celleliv og død.
Cytokrom c er et protein, der findes i mange planter, dyr og encellede organismer. Hos mennesker, dens hovedformål er at transportere elektroner i mitokondrier og hjælpe med apoptose (normal celledød og de processer, der omgiver den). Disse to funktioner er blevet vist i tidligere bestræbelser på at stole på methioninrestens position. Når svovl arbejder med jern, proteinet er klar til at overføre elektroner. Ellers, det engagerer sig i peroxidaseaktiviteter. I denne nye indsats, forskerne søgte bedre at forstå proteinets energi ved at undersøge jern- og svovlbindingen. Entatiske tilstande, Bren og Raven påpeger, er meget vigtige i biouorganisk kemi - det oversættes faktisk til noget, der strækkes, når det udsættes for spændinger.
For bedre at forstå båndet mellem de to elementer, forskerne tvang dem midlertidigt fra hinanden ved hjælp af en Linac Coherent Light Source røntgenfri elektronlaser og målte derefter, hvor lang tid det tog de to komponenter at reformere ved hjælp af jernrøntgenstråleemissionsspektroskopi. De fandt ud af, at det miljø, de eksisterede i, øgede bindingsstyrken med fire kilokalorier pr. mol, hvilket var nok til at tillade proteinet at skifte mellem dets funktionelle tilstande og til at kvantificere energiomkostningerne ved den entatiske tilstand.
Som Bren og Raven bemærker, resultaterne af undersøgelsen har betydning for den rolle, cytokrom spiller i respiration, som de relaterer til levende og apoptose, som de relaterer til døden. For at fremme fortsat levevis hjælper proteinet med at opretholde et vist reduktionspotentiale. Til apoptose, den entatiske tilstand afbrydes, hvilket gør det muligt at øge peroxidaseaktiviteten.
© 2017 Phys.org
 Varme artikler
Varme artikler
-
 5. klasse kemisk forandringsaktivitetEt kemiprojekt for 5. graders bør fremstå som sjovt og mindre som læring. Illustrerende en kemisk reaktion ved at ændre farven på en øre passer til regningen. Dette er et eksperiment, som en 10-årig k
5. klasse kemisk forandringsaktivitetEt kemiprojekt for 5. graders bør fremstå som sjovt og mindre som læring. Illustrerende en kemisk reaktion ved at ændre farven på en øre passer til regningen. Dette er et eksperiment, som en 10-årig k -
 Kan jeg blande disse kemikalier? Der er en app til det!En visuel fremstilling, der viser, hvordan tildeling af graffarveregistre fungerer. Kredit:Jason Ott/UCR Forkert blandede kemikalier forårsager et chokerende antal brande, eksplosioner, og skader
Kan jeg blande disse kemikalier? Der er en app til det!En visuel fremstilling, der viser, hvordan tildeling af graffarveregistre fungerer. Kredit:Jason Ott/UCR Forkert blandede kemikalier forårsager et chokerende antal brande, eksplosioner, og skader -
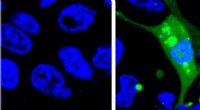 Ny, mere følsom sensor til vurdering af lægemiddelsikkerhedBillede af celler, der udtrykker AgHalo -sensoren før (venstre) og efter (højre) cellestress. AgHalo -sensoren tændes, når fejlfoldede proteiner begynder at aggregeres og giver et kvantitativt mål for
Ny, mere følsom sensor til vurdering af lægemiddelsikkerhedBillede af celler, der udtrykker AgHalo -sensoren før (venstre) og efter (højre) cellestress. AgHalo -sensoren tændes, når fejlfoldede proteiner begynder at aggregeres og giver et kvantitativt mål for -
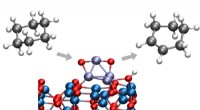 Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved


