Forskere fanger planter i færd med at ændre kemi, der menes at være uforanderlig, fordi den er nødvendig for livet

For første gang har forskere fanget cellemaskineriet, der danner et vigtigt molekyle i udviklingsprocessen. Et nøgleenzym planter bruger til at lave tyrosin, en aminosyre, der er nødvendig for livet, blev anset for at være bevaret i hele planteriget, men forskerne fandt ud af, at det har muteret til en anden form i bælgplanter. I cherrytomater dominerer den kanoniske form af enzymet, jordnødder kan skifte hit og nogle stammer af sojabønner (klumpede bønner til højre) har mistet den kanoniske form. Kredit:Jez Lab
Fordi planter ikke kan rejse sig og løbe væk, de har skullet være kloge i stedet for. De er den levende verdens kemikere, producerer hundredtusindvis af små molekyler, som de bruger som solcremer, at forgifte planteædere, at dufte luften, at farve blomster, og for meget anden hemmelig vegetativ virksomhed.
Historisk set er disse kemikalier, kaldet "sekundære metabolitter, " er blevet skelnet fra "primære metabolitter, "som er byggestenene i proteiner, fedtstoffer, sukkerarter og DNA. Sekundære metabolitter glatter vejen i livet, men de primære metabolitter er essentielle, og undladelsen af at lave dem korrekt og effektivt er fatal.
Sekundær metabolisme menes at have udviklet sig for at hjælpe planteforfædre med at leve på tørt land i stedet for de mere gæstfrie oceaner. Tanken er, at generne for enzymer i de molekylære samlebånd af primær metabolisme blev duplikeret. Duplikaterne var mere tolerante over for mutationer, der kunne have destabiliseret de primære veje, fordi originalerne stadig var på arbejde. Med evolutionære begrænsninger således afslappet, syntetiske maskiner var i stand til at akkumulere nok mutationer til at lave ny kemi.
Primær stofskifte, imidlertid, er vidt bevaret, hvilket betyder, at det forbliver uændret på tværs af mange forskellige grupper af organismer, fordi det er blevet finjusteret til at fungere korrekt og effektivt, og fordi dets produkter er nødvendige for livet. Eller det siger lærebøgerne.
Men nu har et samarbejdende team af forskere fanget primært stofskifte i færd med at udvikle sig. I en omfattende undersøgelse af et samlebånd med primært stofskifte i planter, de opdagede et nøgleenzym, der udviklede sig fra en kanonisk form, som de fleste planter besidder, gennem ikke-kanoniske former i tomater, til en kontaktform, der findes i jordnødder, og endelig forpligte sig til den nye form i nogle stammer af sojabønner.
denne bedrift, sammenlignes med at trække dugen ud under opvasken uden at gå i stykker nogen af dem, er beskrevet i udgaven af 26. juni af Naturens kemiske biologi . Det er arbejdet i et samarbejde mellem Maeda-laboratoriet ved University of Wisconsin, som har en langvarig interesse i denne biokemiske vej, og Jez-laboratoriet ved Washington University i St. Louis, som krystalliserede sojabønneenzymet for at afsløre, hvordan naturen ændrede, hvordan proteinet virker.
"Værket fanger planter i færd med at bygge en vej, der forbinder det primære til det sekundære stofskifte, " sagde Joseph Jez, Howard Hughes Medical Institute professor ved Institut for Biologi i Arts &Sciences. "Vi ser endelig, hvordan evolutionen skaber maskineriet til at lave nye molekyler."
Det kan også have praktisk betydning, fordi de gamle og de nye veje laver aminosyren tyrosin, som er en forløber for mange sekundære metabolitter med biologisk og farmaceutisk aktivitet - alt fra E-vitamin til opioider. Men den gamle vej fremstiller kun små mængder af disse forbindelser, dels fordi de skal konkurrere om kulstofatomer med den grådige proces til fremstilling af lignin, de seje polymerer, der lader planter stå højt.
Opdagelsen af den nye vej til fremstilling af tyrosin er meget mindre begrænset end den gamle. Dette øger muligheden for, at kulstofstrømmen kan ledes væk fra lignin, øge udbyttet af lægemidler eller næringsstoffer til niveauer, der gør det muligt at producere dem i kommercielle mængder.
En fortælling om to enzymer
Tyrosin er lavet på et samlebånd kaldet shikimate-banen, en syv-trins metabolisk vej, som planter bruger til at lave de tre aminosyrer, der har aromatiske ringe. Dyr (inklusive mennesker) mistede evnen til at rejse dette samlebånd dybt i den evolutionære fortid. Fordi vi ikke kan lave disse aminosyrer på egen hånd, og de er essentielle for livet, vi skal i stedet skaffe dem ved at spise planter eller svampe.
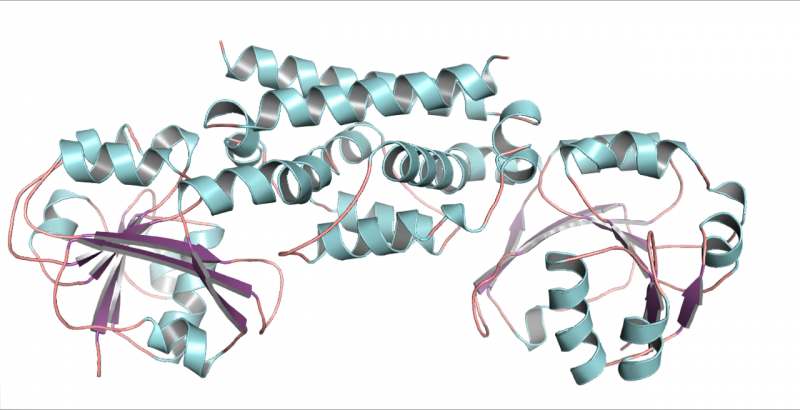
En tredimensionel struktur af PDH-enzymet fra sojabønne, en bælgplante. Denne struktur hjalp med at vise, at kun én mutation tillod bælgfrugter at udvikle en ny måde at fremstille aminosyren tyrosin på. Kredit:Craig Schenck
Den aromatiske ring er vigtig, sagde Jez, fordi det er en karakteristisk struktur, der kan absorbere lys eller energi. Så de aromatiske aminosyrer er også forløbere for mange sekundære metabolitter, der fanger lys, overføre elektroner, eller farve blomster. I øvrigt, de aromatiske aminosyrer er også forløbere for kemikalier, der forgifter andre planter eller planterovdyr og tiltrækker bestøvere. Mange lægemidler inkluderer en aromatisk ring, Jez kommenterede.
I de fleste planter er shikimatvejen i kloroplasten, organellen, der udfører arbejdet med at omdanne sollysets energi til energi lagret i kulstofbindinger. Når først det er lavet, imidlertid, tyrosin kan eksporteres ud af cytosolen til inkorporering eller omdannelse til andre forbindelser.
I det sidste trin af en gren af vejen et enzym kaldet arogenatdehydrogenase (ADH), katalyserer en reaktion, der får forbindelsen til at arogenere til tyrosin. ADH-enzymet betragtes som "regulerende", fordi det er en flaskehals i tyrosinproduktionen. Det skal konkurrere om arogenatsubstratet med grenen af shikimatbanen, der danner en anden aromatisk aminosyre, og det hæmmes stærkt af opbygningen af tyrosin
ADH-aktivitet er almindelig i planter, men i løbet af at studere shikimate-vejen opdagede Maeda-laboratoriet, at DNA-sekvenserne, der koder for ADH i nogle blomstrende planter, var væsentligt forskellige fra dem i de fleste planter. De kaldte enzymerne produceret af disse sekvenser for ikke-kanoniske ADH. Derefter, i 2014, de rapporterede, at nogle bælgplanter også laver tyrosin med et andet enzym, kaldet præphenatdehydrogenase (PDH).
PDH adskiller sig fra ADH på mange måder. Det er aktivt uden for kloroplasten, det virker på substratet præphenat snarere end på arogenat, fordi det er uden for kloroplasten, behøver det ikke at konkurrere om sit substrat med andre grene af shikimatbanen, og det hæmmes ikke af stigende niveauer af tyrosin.
Hvorfor er der to forskellige samlebånd til tyrosin? Forskerne mener, at PDH-enzymet udviklede sig via to genduplikationshændelser og akkumulering af mutationer i de "ekstra" kopier af genet. Den første hændelse gav anledning til ikke-standardiserede ADH'er i nogle blomstrende planter og den anden til PDH i en undergruppe af bælgplanter. Men hvorfor skete dette?
Det er ikke et spørgsmål, som forskerne kan besvare endnu, undtagen i generelle vendinger, sagde Jez. Hvad stikker ud, imidlertid, er, at den mere nyligt udviklede metaboliske vej ikke er stramt reguleret og potentielt kan udskille produktet i et hektisk tempo. Måske havde bælgplanterne et voldsomt behov for sekundære metabolitter af en eller anden grund. Det er bestemt mistænkeligt, at bælgplanter har en økologi, der er helt anderledes end andre planters, da de lever symbiotisk med nitrogenfikserende bakterier.
Fifler med stumperne
På dette tidspunkt vidste forskerne, at det nye enzym, PDH, bundet et andet substrat end det oprindelige enzym, ADH. De vidste også, at PDH, i modsætning til ADH, binder ikke selv tyrosin. Men hvilke ændringer i struktur førte til disse forskelle i kemisk aktivitet?
At finde ud af, Craig Schenck, en kandidatstuderende i Maeda-laboratoriet, sammenlignede gensekvenserne for ADH- eller PDH-enzymet i mange forskellige planter, nøje udvalgt til at være på grænsen af overgangen fra det ene enzym til det andet. Men de stødte på et problem. Der var nok forskelle i DNA'et til, at det var svært at se, hvad der var relevant, sagde Jez.
Møder Maeda på en konference, Jez tilbød at prøve at krystallisere de nye enzymer, så deres struktur kunne rekonstrueres ud fra røntgenbilleder. Hans kandidatstuderende Cynthia Holland var i stand til at krystallisere sojabønne-PDH og producere detaljerede billeder af dens tredimensionelle form.
"Når du så på strukturen, kunne du se, at der kun var to forskelle fra den typiske ADH, der findes i de fleste planter, og kun en af forskellene ændrede faktisk tingene, " sagde Jez. Forbløffende nok var den forskel en enkelt aminosyre i det aktive sted på enzymet. På det sted havde asparaginen erstattet asparaginsyre.
Schenck dobbelttjekkede denne strukturelle indsigt ved at vende den aminosyre i mutante former af enzymet. ADH-mutanten viste sig at have PDH-aktivitet, og PDH-mutanten havde ADH-aktivitet, ligesom holdet havde mistænkt.
"Denne forskel ændrer enzymets foretrukne substrat og dets evne til at blive hæmmet af tyrosin-feedback, " sagde Jez. "Og hvis du ser på det, det er bogstaveligt talt forskellen mellem et nitrogenatom eller et oxygenatom. I disse proteiner, som består af næsten tre hundrede aminosyrer eller toogfyrre hundrede atomer, ét atom gør hele forskellen. Det er bare lidt fedt."
Arbejdet er vigtigt, fordi det viser, at primært stofskifte udvikler sig. Og fordi det viser, hvordan naturen stjæler maskineri fra det primære stofskifte og samler det for at lave nye sekundære metabolitter. De gør dette med meget mere finesse, end genteknikere endnu kan klare.
"Når vi vil have en plante til at lave et nyt molekyle, "Jez sagde, "Vi falder i et gen og håber, at det integreres med eksisterende veje. Vi ved stadig ikke, hvordan vi nemt kan forbinde ledningerne mellem det, vi falder ind, og det, der allerede er der. Så det er interessant at se, hvordan naturen har fundet på at forbinde ledningerne og ændre tingene uden at ødelægge dem."
Sidste artikelForskning i aktive stoffer i modermælk kan begynde
Næste artikel3-D-printede krukker i kuglefræsningseksperimenter
 Varme artikler
Varme artikler
-
 Enkel bytte til et grønnere værktøjskasseEn bidentat ligand (orange og grå) på nikkelatomet (blå) fremmer eliminering af carbonyl i esteren (grøn og rød) i denne overgangstilstand. Kredit:KAUST En metalkatalysator, der giver tydelige car
Enkel bytte til et grønnere værktøjskasseEn bidentat ligand (orange og grå) på nikkelatomet (blå) fremmer eliminering af carbonyl i esteren (grøn og rød) i denne overgangstilstand. Kredit:KAUST En metalkatalysator, der giver tydelige car -
 Biokemikere forbinder polyfenoler i ferskenblade med deres ekstrakts antioxidanteffektKredit:RUDN Universitet Biokemikere fra RUDN University har fastslået, hvilke stoffer i ferskenblade, der giver den antioxidante virkning af deres ekstrakt. De undersøgte sammensætningen af pulv
Biokemikere forbinder polyfenoler i ferskenblade med deres ekstrakts antioxidanteffektKredit:RUDN Universitet Biokemikere fra RUDN University har fastslået, hvilke stoffer i ferskenblade, der giver den antioxidante virkning af deres ekstrakt. De undersøgte sammensætningen af pulv -
 Eksperimentelle fysikere studerer stål om bord på ISSPeter Pichler (tv) med arbejdsgruppeleder Gernot Pottlacher (th.). Fra stålstangen i deres hænder, de skar de små bolde, som nu bliver undersøgt på ISS. Kredit:Baustädter - TU Graz I mange år, Ins
Eksperimentelle fysikere studerer stål om bord på ISSPeter Pichler (tv) med arbejdsgruppeleder Gernot Pottlacher (th.). Fra stålstangen i deres hænder, de skar de små bolde, som nu bliver undersøgt på ISS. Kredit:Baustädter - TU Graz I mange år, Ins -
 Hvis lyset tændes og slukkes, bliver bakterier til kemiske fabrikkerPrinceton University-forskere opfandt en metode til at bruge lys til at tænde og slukke for en mekanisme i E. coli-bakterier, som er nøglen til at få bakterierne til at producere værdifulde kemikalier
Hvis lyset tændes og slukkes, bliver bakterier til kemiske fabrikkerPrinceton University-forskere opfandt en metode til at bruge lys til at tænde og slukke for en mekanisme i E. coli-bakterier, som er nøglen til at få bakterierne til at producere værdifulde kemikalier
- Geovidenskabsforskere vil bruge data fra den nye NASA-lander til at lære om Mars indre, kerne
- Team identificerer lavenergisolpartikler fra hinsides Jorden nær Solen
- Frigivelse af næringsstoffer fra søbundsedimenter forværrer Lake Eries årlige døde zone
- Forskere observerer rettet energitransport mellem nabomolekyler i et nanomateriale
- Ny indsigt bringer bæredygtig brint et skridt nærmere
- Hvordan fungerer en sugekop?


