Koder smart antibiotika

Kredit:National Physical Laboratory
En metode til at designe antibiotika baseret på tilfældig binær kodning, udviklet af et team ledet af National Physical Laboratory (NPL), kunne åbne op for nye muligheder inden for lægemiddelopdagelse.
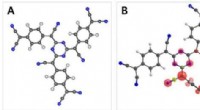
Biologisk aktivitet er kodet i molekylære sekvenser af tyve unikke aminosyrer. Antimikrobiel aktivitet er ingen undtagelse og er programmeret i korte sekvenser kaldet antimikrobielle peptider, som bruges af vores immunforsvar til at bekæmpe bakterier.
Da spredningen af antimikrobiel resistens driver behovet for stærkere, hurtigere og mere selektive behandlinger, forskere udvikler nye sekvenser baseret på disse naturligt forekommende peptider til brug i antimikrobielle terapier. Imidlertid, meget er stadig ukendt om sådanne sekvenser – især, hvilke sekvenser er mest effektive mod bakterier uden at skade vores egen krops celler? Og hvilke strukturelle træk driver selektivitet?
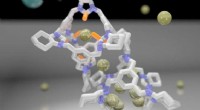
Et internationalt team af forskere under ledelse af NPL satte sig for at undersøge antimikrobiel selektivitet ved at oprette to sæt af millioner af tilfældige antimikrobielle sekvenser bygget af kun to aminosyrer. Det første sæt sekvenser, de skabte, blev forudsagt til effektivt at dræbe bakterier og samtidig påvirke menneskelige røde blodlegemer; det andet sæt sekvenser blev skabt til udelukkende at målrette bakterieceller.
For at opnå dette, teamet udnyttede ejendommen ved kiralitet ved at erstatte en af de to aminosyrer med sit spejlbillede. Alle naturligt forekommende proteinsekvenser er chirale (dvs. ikke identiske med deres spejlbillede), en egenskab, der fører til, at deres omvendte chiralitet (spejlbillede) former ikke kan påvirke vores immunsystem. I modsætning, bakterier skifter ofte chiralitet til at producere antibiotika, der er i stand til at bekæmpe andre bakterier, og kan derfor blive påvirket af sekvenser med omvendt chiralitet.
Følgelig, sættet af antimikrobielle sekvenser med delvist omvendt chiralitet dræbte effektivt bakterier, inklusive superbugs MRSA og VSE, uden at påvirke menneskelige celler negativt, selv ved meget høje koncentrationer. Mest påfaldende, de to sæt sekvenser udviste to fundamentalt forskellige fysiske mekanismer - de giftige homochirale sekvenser havde en tendens til at perforere bakterielle membraner, mens de meget selektive sekvenser med omvendt chiralitet ikke efterlod nogen synlige markeringer på membranoverflader.
Fundene, rapporteret i journalen Angewandte Chemie og udført i samarbejde med det hebraiske universitet i Jerusalem, University of Brighton, University of Western Australia og University of Oxford, kunne åbne op for nye muligheder inden for opdagelse af lægemidler for kodning af meget selektive antimikrobielle stoffer.
Reproducerbare målinger af antimikrobiel aktivitet er afgørende for at sikre tillid til den næste generation af sikre, effektive behandlinger, og NPL's Bioteknologi-gruppe udvikler den måleinfrastruktur, der er nødvendig for at understøtte antimikrobiel opdagelse og udvikling.
Sidste artikelPåvisning af fermenteringsprocesser i el-genererende bakterier
Næste artikelEn ende på huller for folk med følsomme tænder?
 Varme artikler
Varme artikler
-
 Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST
Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST -
 Solceller:Kortlægning af landskabet for cæsiumbaserede uorganiske halogenidperovskitterAlle prøver er blevet udskrevet i HySPRINT-laboratoriet på HZB. Kredit:H. Näsström/HZB Forskere ved HZB har trykt og undersøgt forskellige sammensætninger af cæsiumbaserede halogenidperovskitter (
Solceller:Kortlægning af landskabet for cæsiumbaserede uorganiske halogenidperovskitterAlle prøver er blevet udskrevet i HySPRINT-laboratoriet på HZB. Kredit:H. Näsström/HZB Forskere ved HZB har trykt og undersøgt forskellige sammensætninger af cæsiumbaserede halogenidperovskitter ( -
 Opfindelsen af bittesmå organiske film kunne muliggøre ny elektronikForskere opdagede en ny metode til at samle tusindvis af organiske molekyler til en glat flad film, kun få nanometer tyk, vist her i denne illustration. Kredit:Baorui Cheng Den første mobiltelefon
Opfindelsen af bittesmå organiske film kunne muliggøre ny elektronikForskere opdagede en ny metode til at samle tusindvis af organiske molekyler til en glat flad film, kun få nanometer tyk, vist her i denne illustration. Kredit:Baorui Cheng Den første mobiltelefon -
 Burmolekyler fungerer som molekylsigter til adskillelse af brintisotopDannelse af en cocrystal forbedrer D2/H2-separationsydelsen. Kredit:University of Liverpool Et nyt hybridmateriale udviklet af forskere ved University of Liverpool kan bringe drømmen om kulstoffri
Burmolekyler fungerer som molekylsigter til adskillelse af brintisotopDannelse af en cocrystal forbedrer D2/H2-separationsydelsen. Kredit:University of Liverpool Et nyt hybridmateriale udviklet af forskere ved University of Liverpool kan bringe drømmen om kulstoffri
- Sådan fjerner du Iron Filings From Magnets
- Forbedring af jordskælvsresistens med en enkelt krystal
- NASA ser vindforskydning påvirke den tropiske storm Yagi
- Platin danner nano-bobler
- Kemikere udvikler forskellige industrielt vigtige syntetiske processer
- Undersøgelse identificerer hot spots for krænkelser af vandkvaliteten


