Hvad en sjælden blodsygdom kan lære os om blodpropper
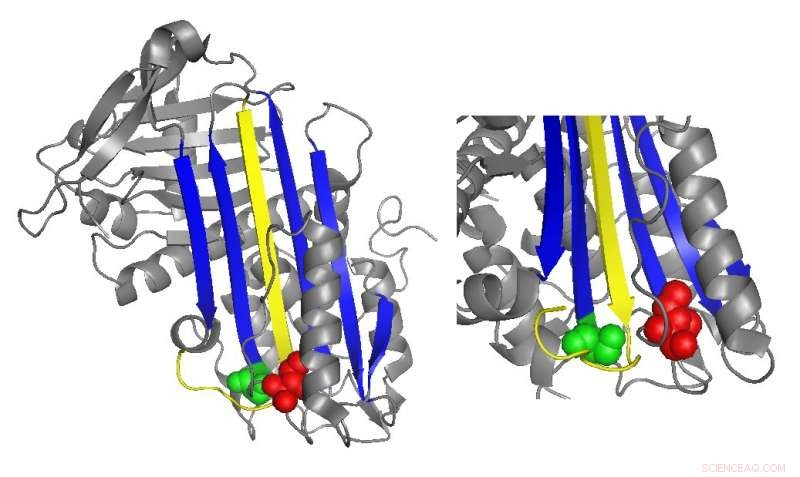
Et bånddiagram af antithrombin fremhæver placeringer af funktionelt vigtige mutationer. Kredit:Irene Martinez-Martinez
Når en person kommer til skade, blodpropper er afgørende. Imidlertid, når faren er forbi, det er lige så vigtigt at stoppe koagulationsreaktionen for at forhindre trombose, eller blokering af blodgennemstrømningen af blodpropper. Et protein kaldet antithrombin er ansvarlig for at stoppe koagulation, men omkring én ud af to tusinde mennesker har en arvelig mangel på antitrombin, der sætter dem i meget højere risiko for livstruende blodpropper.
En gruppe forskere i Spanien har analyseret mutationerne i disse patienters antithrombinproteiner og opdaget, at en del af proteinet spiller en uventet rolle i dets funktion. Denne indsigt i, hvordan antitrombin virker, kunne føre til behandlinger ikke kun for patienter med antitrombinmangel, men også til bedre designet lægemidler til andre blodsygdomme. Forskningen vil blive offentliggjort i 6. oktober-udgaven af Journal of Biological Chemistry .
Centro Regional de Hemodonacion og Hospital Universitario Morales Meseguer fra Universidad de Murcia i Spanien er et referencecenter for diagnosticering af antitrombinmangel. I mere end 15 år, forskere ved laboratoriet har modtaget prøver fra patienter med forskellige mutationer, der påvirker, hvordan deres antitrombin virker.
Antithrombin hæmmer normalt thrombin ved at indsætte et løkkeformet område, kaldet den reaktive centerløkke, ind i det aktive sted af thrombinproteinet, forhindrer thrombin i at katalysere koageldannelse ved at forvrænge formen af thrombinets aktive sted. Mange antitrombinmutationer, der forårsager koagulationssygdomme, påvirker direkte eller indirekte den reaktive centerløkke. Imidlertid, biokemiske undersøgelser ledet af Irene Martinez-Martinez opdagede, at mutationer i en helt anden del af antitrombinet også bidrog til dets dysfunktion.
"Vi så, at vi [havde] mutanter, der påvirkede proteinets funktion, selvom de var meget langt fra hoveddelen af proteinet, der er ansvarlig for hæmningen, " sagde Martinez-Martinez. "Folk troede, at antitrombinfunktionen hovedsageligt var fokuseret på ét domæne af proteinet. Med dette arbejde, vi har indset, at det ikke er sandt."
Forskernes analyser af de nye mutationer antydede, at domænet af antithrombinet i den modsatte ende af den reaktive centerløkke hjælper med at holde thrombinet fanget i dets endelige, forvrænget form. Da der var specifikke mutationer i denne region, Thrombinet var oftere i stand til at vende tilbage til sin aktive form og nedbryde og frigive antithrombinet.
Martinez-Martinez håber, at forståelsen af vigtigheden af denne region af antitrombin kan føre til bedre lægemidler til at forhindre blodkoagulation ved at aktivere antitrombin eller forhindre blødning ved at hæmme det. Hun understreger også, at den væsentlige natur af dette domæne af proteinet ikke kunne have været forudsagt ved blot at studere sekvenserne af sunde antithrombiner.
"Dette arbejde har været muligt takket være karakteriseringen af mutationer identificeret hos patienter, " sagde Martinez-Martinez.
Arbejdet blev finansieret af fondene Instituto de Salud Carlos III og FEDER samt Fundación Séneca.
 Varme artikler
Varme artikler
-
 Forvandling af træ til plastikKredit:Unsplash/CC0 Public Domain Bestræbelser på at skifte fra petrokemisk plast til vedvarende og bionedbrydelig plast har vist sig vanskelig - produktionsprocessen kan kræve giftige kemikalier
Forvandling af træ til plastikKredit:Unsplash/CC0 Public Domain Bestræbelser på at skifte fra petrokemisk plast til vedvarende og bionedbrydelig plast har vist sig vanskelig - produktionsprocessen kan kræve giftige kemikalier -
 Hvad er fotosyntesekvationen?Fotosyntese, der er afledt af det græske ord foto, der betyder lys og syntese sætte sammen er en proces, der anvendes af planter og nogle bakterier til at udnytte energien fra sollys til at omdanne va
Hvad er fotosyntesekvationen?Fotosyntese, der er afledt af det græske ord foto, der betyder lys og syntese sætte sammen er en proces, der anvendes af planter og nogle bakterier til at udnytte energien fra sollys til at omdanne va -
 Et materiale med et særligt twist:2-D molybdæn diselenid krystalElektroner (grønne) i en skive af det snoede sandwichmateriale. Materialets egenskaber kan studeres ved hjælp af elektroner (sort/rød) exciteret af laserlys. Kredit:ETH Zürich / Yuya Shimazaki I e
Et materiale med et særligt twist:2-D molybdæn diselenid krystalElektroner (grønne) i en skive af det snoede sandwichmateriale. Materialets egenskaber kan studeres ved hjælp af elektroner (sort/rød) exciteret af laserlys. Kredit:ETH Zürich / Yuya Shimazaki I e -
 At få dufte til at vare længereEn sensor, der normalt bruges i fødevareindustrien, kan registrere, hvor længe dufte varer på huden. Kredit:Ashland Fra blomsterparfume til frugtagtig kropsvask og shampoo, dufte har stor indflyde
At få dufte til at vare længereEn sensor, der normalt bruges i fødevareindustrien, kan registrere, hvor længe dufte varer på huden. Kredit:Ashland Fra blomsterparfume til frugtagtig kropsvask og shampoo, dufte har stor indflyde


