Forskere undersøger måder, hvorpå et lægemiddel som Avandia kan gøres mere sikkert
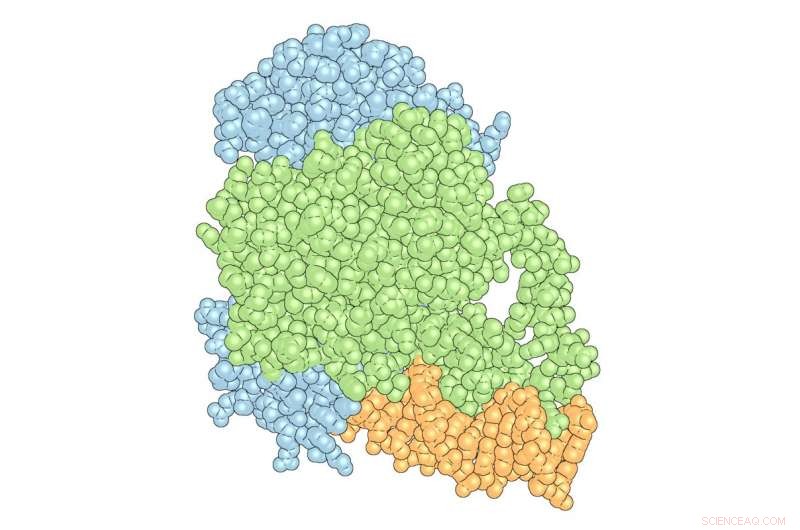
'Komplekset' af PPARγ (grøn) og RXRα (blå) med DNA (orange). Kredit:Scripps Research Institute
Med de øgede bekymringer over de farlige bivirkninger af det engang populære antidiabetika, Avandia, forskere ved The Scripps Research Institute (TSRI) i Jupiter, Florida, arbejder på at forstå, hvordan små molekyler, som dem i Avandia, kan have så forskellige effekter i hele kroppen. Indsigten kan hjælpe forskere med at designe nye lægemidler med bedre effekt og færre bivirkninger.
Douglas Kojetin, lektor ved TSRI, og hans team offentliggjorde for nylig en undersøgelse i Struktur , viser de måder, Avandia interagerer med og ændrer formen på en kombination af proteiner, receptorer og DNA - kaldet "komplekset" - hvilket resulterede i lægemidlets virkninger. Ud over at hjælpe med at informere design af fremtidige antidiabetika, undersøgelsen afslørede, at DNA spiller en aktiv rolle i bestemmelsen af kompleksets struktur, et fund, der har implikationer for at forstå, hvordan et lægemiddel til små molekyler påvirker kroppen.
Forskere i Kojetins laboratorium fokuserer på nukleare receptorer - proteiner, der kan interagere eller "binde" til både genetisk materiale, såsom DNA og små molekyler, samt binde til andre proteiner kaldet coregulatoriske proteiner, der påvirker genekspression. Avandia, for eksempel, binder til PPARγ, en nuklear receptor, som binder sig til DNA -sekvenser, der er vigtige for regulering af fedtopbevaring og metabolisme. Men PPARγ fungerer ikke alene med Avandia. En anden nuklear receptor, RXRα, interagerer med PPARγ for at danne en "heterodimer", et kompleks bestående af to forskellige proteiner bundet sammen, der rekrutterer et co-regulatorisk protein kaldet Steroid Receptor Coactivator-2 (SRC-2) for at påvirke aktiviteten af mange forskellige gener. Når hvert stykke binder, komplekset ændrer form, som stykker vådt ler, der moser sammen til en skål.
Teamet satte sig for at forstå, hvordan specifikke sektioner af DNA påvirker interaktionen mellem den nukleare receptor og det koregulatoriske protein. For eksempel, ville denne nukleare receptor interagere med det coregulatoriske protein på samme måde, hvis den ikke var bundet til DNA?
Tilføjelse af et ekstra lag af kompleksitet, SRC-2 er et iboende uordentligt protein-et "floppy" protein uden en konsekvent sekundær struktur, der flopper rundt som en løs spaghetti-nudel. Dette betyder, at populære metoder, som forskere typisk ville bruge til at forstå proteinets struktur, som røntgenkrystallografi, som kræver en stabil unflopy -prøve, ville ikke være i stand til at fortælle forskerne meget om, hvad dette protein gør.
Kojetins team brugte en kombination af kvantitativ biokemisk, biofysiske og løsningsmæssige strukturelle metoder til at danne en detaljeret forståelse af disse molekylære interaktioner. Hver teknik gav sit team oplysninger, som de brugte til at bygge et billede af, hvordan alle disse molekyler interagerer.
"Ingen værktøjer kunne have givet os svaret. Det var virkelig kombinationen af alle disse værktøjer, der gav os et fuldstændigt billede af, hvad der foregik, "Sagde Kojetin.
Det viste sig, at det, der foregik, var en "termodynamisk" mekanisme, ved hvilken binding til DNA fik receptor -heterodimeren til at ændre dens form og vigtigere stabilisere dens disketteområder.
Kojetins team viste, at DNA -interaktion påvirkede Avandias styrke og dets evne til at rekruttere det regulerende protein. Receptorerne alene er som to balloner, der tilfældigt flyder rundt i vinden, forklarede Kojetin. Når det bundet til DNA'et, receptorerne stabiliseres, som om ballonerne var bundet sammen, gør det lettere for SRC-2 at interagere med det.
Hvis proteinerne havde bundet sig til en anden del af DNA, komplekset kan have været i stand til at danne en anden form og udøve en anden, muligvis endda farlig effekt, eller måske slet ingen effekt. Forskellige gener afsløres, eller tilgængelig, i forskellige kropsvæv. Dette kan hjælpe med at forklare, hvordan medicin kan have en effekt i et bestemt område af kroppen og en anden effekt på andre områder, hvor sektionerne af tilgængeligt DNA er forskellige.
"Lægemidlet styrer ikke aktiviteten i kroppen i sig selv. Når receptoren er bundet til forskellige DNA -sekvenser, aktiviteten af lægemidlet kunne ændres. "Ved at vide dette, sagde Kojetin, "vil åbne mange muligheder."
 Varme artikler
Varme artikler
-
 Høj effektivitet, billig katalysator til vandelektrolyseOxygenudvikling på overfladen af kerne-skal Co@NC elektrode i alkalisk vandelektrolyse. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold ledet af professor Sanga
Høj effektivitet, billig katalysator til vandelektrolyseOxygenudvikling på overfladen af kerne-skal Co@NC elektrode i alkalisk vandelektrolyse. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold ledet af professor Sanga -
 Ny jernbaseret katalysator øger omdannelsen af CO2 til højere alkoholerAfslører den fremmende rolle af S i syntese af højere alkoholer over jernkatalysatorer. Kredit:YAO Ruwei Højere alkoholer (C 2+ Åh), vigtige mellemprodukter til finkemikalier, produceres hovedsa
Ny jernbaseret katalysator øger omdannelsen af CO2 til højere alkoholerAfslører den fremmende rolle af S i syntese af højere alkoholer over jernkatalysatorer. Kredit:YAO Ruwei Højere alkoholer (C 2+ Åh), vigtige mellemprodukter til finkemikalier, produceres hovedsa -
 Konstruerede bakterielle biofilm, der immobiliserer nanopartikler, muliggør forskellige katalytiske…Forskellige katalytiske anvendelser af tunable funktionel E coli biofilm med forankrede nanoobjekter. (a) De biofilmforankrede Au NPer muliggør den genanvendelige katalytiske reduktion af den giftig
Konstruerede bakterielle biofilm, der immobiliserer nanopartikler, muliggør forskellige katalytiske…Forskellige katalytiske anvendelser af tunable funktionel E coli biofilm med forankrede nanoobjekter. (a) De biofilmforankrede Au NPer muliggør den genanvendelige katalytiske reduktion af den giftig -
 Molekylære fabrikker:Kombinationen mellem natur og kemi er funktionelPå molekylære fabrikker injiceret i zebrafiskembryoner, en farvereaktion opstår, når det fangede enzym (peroxidase) virker. Forskerne beviser således, at kombinationen af syntetiske organeller og na
Molekylære fabrikker:Kombinationen mellem natur og kemi er funktionelPå molekylære fabrikker injiceret i zebrafiskembryoner, en farvereaktion opstår, når det fangede enzym (peroxidase) virker. Forskerne beviser således, at kombinationen af syntetiske organeller og na
- Squishy hydras simple kredsløb klar til deres nærbillede
- Mekaniske ulemper ved et løftesystem
- Kvanteusikkerhed hjælper med at løse et gammelt problem
- Skovbrande og storme truer vandforsyningen og meget mere
- Undersøgelse kaster lys over målerinvarians i ultra-koblingskavitets kvantelektrodynamik
- Ideelle ægteskabspartnere driver Waorani -krigere i krig


