Forskere udvikler body-on-a-chip-system til at fremskynde test af nye lægemidler
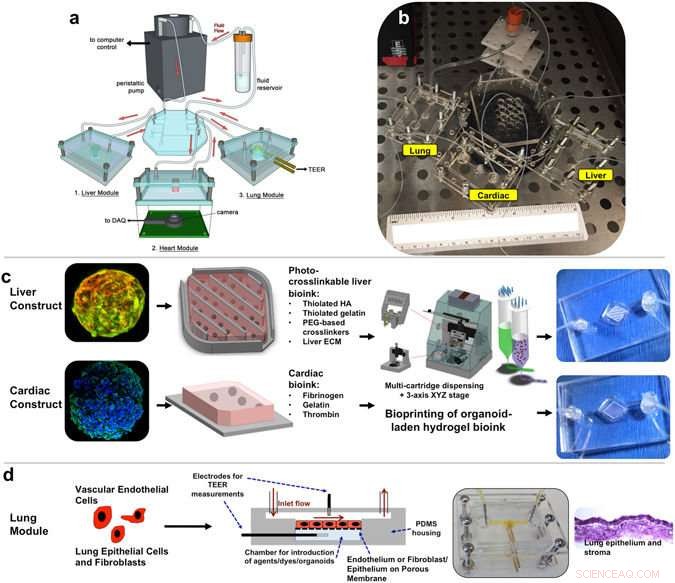
Overordnet design- og implementeringsstrategi for det 3-vævsrepræsentative organ-på-en-chip-system ved hjælp af en række biofabrikationstilgange. (en, b) Illustration og fotografi af det modulære multi-tissue organ-on-a-chip hardware system opsat til vedligeholdelse af 3 vævsmodel. Individuelle mikrofluidiske mikroreaktorenheder huser hver organoid eller vævsmodel, og er forbundet via et centralt fluid routing breadboard, muliggør enkel "plug-and-play" initialisering af systemforberedelse. (c, d) Generelt overblik over, hvordan hver vævstype er forberedt til systemet. (c) Lever- og hjertemoduler skabes ved at bioprinte sfæriske organoider i tilpassede bioblæk, resulterer i 3D-hydrogelkonstruktioner, der placeres i mikroreaktorenhederne. (d) Lungemoduler dannes ved at skabe lag af celler over porøse membraner i mikrofluidiske enheder. Introduktion af TEER (trans-endoteliale [eller epiteliale] elektriske modstandssensorer tillader overvågning af vævsbarrierefunktionsintegritet over tid. Kredit: Videnskabelige rapporter (2017). DOI:10.1038/s41598-017-08879-x
Ved at bruge den samme ekspertise, som de har brugt til at bygge nye organer til patienter, forskere ved Wake Forest Institute for Regenerative Medicine og kolleger har konstrueret mikrohjerter, lunger og lever, der potentielt kan bruges til at teste nye lægemidler. Ved at kombinere mikroorganerne i et overvåget system, forskerne sigter mod at efterligne, hvordan den menneskelige krop reagerer på medicin.
Målet med indsatsen, kendt som en "body-on-a-chip", " er at hjælpe med at reducere den anslåede pris på 2 milliarder dollars og 90 procent fejlrate, som farmaceutiske virksomheder står over for, når de udvikler nye lægemidler. Lægemiddelforbindelser screenes i øjeblikket i laboratoriet ved hjælp af menneskelige celler og testes derefter i dyr. Men ingen af disse metoder replikerer tilstrækkeligt, hvordan medicin påvirker menneskelige organer.
"Der er et presserende behov for forbedrede systemer til nøjagtigt at forudsige virkningerne af stoffer, kemikalier og biologiske stoffer på den menneskelige krop, " sagde Anthony Atala, M.D., direktør for instituttet og seniorforsker i multiinstitutionsorganet på et chipprojekt, finansieret af Defence Threat Reduction Agency.
I Videnskabelige rapporter , udgivet af Natur , forskerholdet rapporterer succes med at lave 3D-organer i mikrostørrelse, kendt som organoider, og forbinde dem sammen på en enkelt platform for at overvåge deres funktion. Mens andre hold har kombineret celler fra flere organer i et lignende system, dette er den første rapporterede succes ved at bruge 3D-organstrukturer, kendt for at fungere bedre og mere præcist modellere den menneskelige krop.
Organstrukturerne blev lavet af celletyper fundet i naturligt menneskeligt væv ved hjælp af 3D-print og andre metoder. Hjerte og lever blev udvalgt til systemet, fordi toksicitet for disse organer er en væsentlig årsag til lægemiddelkandidatfejl og tilbagekaldelse af lægemidler. Lungerne er indgangspunktet for giftige partikler og også for aerosolmedicin, såsom astmainhalatorer.
Organoiderne anbringes i en forseglet, overvåget system - komplet med realtidskamera. En næringsstoffyldt væske, der cirkulerer gennem systemet, holder organoiderne i live og bruges til at introducere potentielle lægemiddelterapier i systemet.
Forskerne testede først organoiderne for at sikre deres lighed med menneskelige organer. For eksempel, mikroleveren fik en høj dosis af et almindeligt smertestillende middel – og så et andet lægemiddel til at modvirke de toksiske virkninger.
"Dataene viser en betydelig toksisk reaktion på lægemidlet samt afbødning af behandlingen, nøjagtigt afspejler de reaktioner set hos menneskelige patienter, sagde Aleks Skardal, Ph.D., assisterende professor ved Wake Forest Institute for Regenerative Medicine, der repræsenterede multi-etterforsker-teamet som hovedforfatter af papiret.
Men vigtigere end hvordan et individuelt organ reagerer på medicin er, hvordan kroppen som helhed reagerer. I mange tilfælde under afprøvning af nye lægemiddelkandidater - og nogle gange endda efter lægemidlerne er blevet godkendt til brug - har lægemidler uventede toksiske virkninger i væv, der ikke er direkte målrettet af selve lægemidlerne.
"Hvis du kun screener et lægemiddel i leveren, for eksempel, du kommer aldrig til at se en potentiel bivirkning på andre organer, "sagde Skardal." Ved at bruge et multi-tissue-organ-on-a-chip-system, du kan forhåbentlig identificere toksiske bivirkninger tidligt i lægemiddeludviklingsprocessen, som kunne redde liv såvel som millioner af dollars."
Forskerne gennemførte flere scenarier for at sikre, at body-on-a-chip-systemet efterligner en respons fra flere organer. For eksempel, de introducerede et lægemiddel, der bruges til at behandle kræft, i systemet. Kendt for at forårsage ardannelse i lungerne, stoffet påvirkede også uventet systemets hjerte. Imidlertid, et kontroleksperiment med kun hjertet viste ingen respons.
Forskerne teoretiserer, at stoffet forårsagede, at inflammatoriske proteiner fra lungen blev cirkuleret i hele systemet. Som resultat, hjertet øgede slag og stoppede senere helt, indikerer en giftig bivirkning.
"Dette var fuldstændig uventet, men det er den type bivirkning, der kan opdages med dette system i lægemiddeludviklingspipelinen, sagde Skardal.
Forskere arbejder på at øge hastigheden af systemet til storskala screening, og også at tilføje yderligere organer.
"Til sidst forventer vi at demonstrere nytten af et body-on-a-chip-system, der indeholder mange af de vigtigste funktionelle organer i menneskekroppen, " sagde Atala. "Dette system har potentiale til avanceret lægemiddelscreening og også til at blive brugt i personlig medicin - for at hjælpe med at forudsige en individuel patients reaktion på behandlingen."
Flere patentansøgninger omfattende teknologien beskrevet i manuskriptet er blevet indgivet.
 Varme artikler
Varme artikler
-
 AlScN – alternativt materiale til mere effektiv smartphone-hardwareBearbejdede overflade akustiske bølgestrukturer (SAW) på AlScN/Si-lag (venstre) og AlScN/Al2O3-lag (højre). Kredit:Fraunhofer-Gesellschaft 5G mobile dataoverførsler kræver brug af flere og højere
AlScN – alternativt materiale til mere effektiv smartphone-hardwareBearbejdede overflade akustiske bølgestrukturer (SAW) på AlScN/Si-lag (venstre) og AlScN/Al2O3-lag (højre). Kredit:Fraunhofer-Gesellschaft 5G mobile dataoverførsler kræver brug af flere og højere -
 Forskere udvikler værktøj til hurtig diagnosticering af bakterielle infektionerMohammad Zarifi, en assisterende professor ved UBC Okanagan, viser sin lille biosensor, der kan bruges til at stille en realtidsdiagnose af en bakteriel infektion. Kredit:UBC Okanagan Ved hjælp af
Forskere udvikler værktøj til hurtig diagnosticering af bakterielle infektionerMohammad Zarifi, en assisterende professor ved UBC Okanagan, viser sin lille biosensor, der kan bruges til at stille en realtidsdiagnose af en bakteriel infektion. Kredit:UBC Okanagan Ved hjælp af -
 På jagt efter stabile væskerDette kort er baseret på et Copernicus Sentinel-2-billede erhvervet den 11. august 2020 og giver en analyse af det seneste olieudslip i Mauritius. I juli, et olieskib gik på grund på koralrevet ud for
På jagt efter stabile væskerDette kort er baseret på et Copernicus Sentinel-2-billede erhvervet den 11. august 2020 og giver en analyse af det seneste olieudslip i Mauritius. I juli, et olieskib gik på grund på koralrevet ud for -
 Hvordan man gør vandet klart efter tilsætning af madfarveBørn elsker at se videnskabseksperimenter, der trodser deres virkelighedskoncept. En lille mængde blegemiddel, der leveres sammen med en øjendråber, ændrer farven på farvet vand, hvilket får farven
Hvordan man gør vandet klart efter tilsætning af madfarveBørn elsker at se videnskabseksperimenter, der trodser deres virkelighedskoncept. En lille mængde blegemiddel, der leveres sammen med en øjendråber, ændrer farven på farvet vand, hvilket får farven
- Billede:Sevilla, Spanien fra kredsløb
- 5 skjulte ædelstene kører ombord på NASAs Perseverance-rover
- Tyve års planetarisk forsvar
- At lære derhjemme, børn har brug for mere end blot undervisningsmaterialer. Deres hjerner skal ogs…
- Forskere udvikler ny metode til at detektere ilt på exoplaneter
- Toshiba afslører en robot, der skal undersøge smeltet Fukushima-atombrændsel


