Ny model afslører muligheden for at pumpe antibiotika ind i bakterier
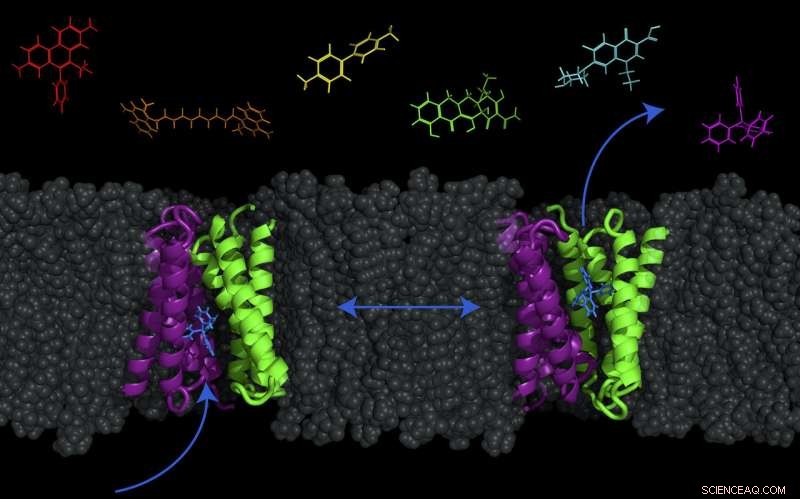
Et transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud af eller ind i cellen. Kredit:Katherine Henzler-Wildman/UW-Madison.
Forskere ved University of Wisconsin-Madison Department of Biochemistry har opdaget, at en cellulær pumpe, der er kendt for at flytte lægemidler som antibiotika ud af E. coli-bakterier, har potentialet til også at bringe dem ind, åbne nye forskningslinjer i bekæmpelse af bakterierne.
Opdagelsen kunne omskrive næsten 50 års tænkning om, hvordan disse typer transportører fungerer i cellen.
Celler skal bringe og fjerne forskellige materialer for at overleve. For at opnå dette, de bruger forskellige transporterproteiner i deres cellemembraner, hvoraf de fleste er drevet af det, der kaldes protonens drivkraft. Protonens drivkraft er rettet mod indersiden af cellen i bakterier, hvilket betyder, at protoner naturligt ønsker at bevæge sig ind i cellen udefra og gør det, hvis der er en vej for dem. Disse transportører tillader den målte bevægelse af protoner ind i cellen - og i bytte for protoner, der bevæger sig ind, lægemiddelmolekyler bliver udstødt.
Man har længe troet, at denne koblede udveksling af protoner (ind) og stoffer (ud) af transportøren var meget streng. Imidlertid, i en undersøgelse offentliggjort i dag (7. november, 2017) i bladet Proceedings of the National Academy of Sciences , UW-Madison biokemiprofessor Katherine Henzler-Wildman og samarbejdspartnere ved Washington University School of Medicine i St. Louis har fundet ud af, at for E. coli's lille multidrug resistenstransporter, kaldet EmrE, proton- og lægemiddelbevægelser er ikke så strengt koblet. Denne transportør kan faktisk også flytte lægemidler og protoner hen over membranen i samme retning, såvel som den modsatte retning - at introducere muligheden for at flytte molekyler både ind eller ud af cellen.
Denne mindre detalje har store konsekvenser, siger forskerne. De modeller, forskerne har brugt i næsten 50 år til at visualisere, hvordan disse transportører fungerer, tager ikke højde for de nye data. Det betyder også, at det kan være muligt for medicin at blive pumpet ind i cellen.
"De langsigtede implikationer er, at denne multi-drug transporter er reversibel, " siger Henzler-Wildman. "Så i stedet for at pumpe medicin ud for at give resistens, du har muligheden for, at du kan bruge den til at pumpe medicin ind for at dræbe bakterier. Indtagelse af stoffer er et stort problem, så dette er et nyt område at udforske."

Biokemiprofessor Henzler-Wildman i National Magnetic Resonance Facility i Madison, til huse i UW-Madisons afdeling for biokemi. Kredit:UW-Madison/ Robin Davies
Hun tilføjer, at denne undersøgelse og hendes tidligere arbejde tyder på, at ved at manipulere miljøforholdene eller selve stoffet, forskerne kan muligvis ikke kun kontrollere transporthastigheden, men også dens retning - i hvert fald i reagensglas i laboratoriet. At forsøge at bekræfte dette i bakterier er et af de næste trin i deres forskning, hun siger.
"Vi startede med et meget grundlæggende videnskabeligt spørgsmål om 'hvordan fungerer disse transportører?' og er faldet over denne virkelig translationelle retning, " siger hun. "Folk har forsøgt at målrette den slags pumper for at stoppe antibiotikaresistens for at gøre antibiotika, som vi allerede har effektive igen. Dette tyder på, at du måske ikke bare kan stoppe det, men rent faktisk kan bruge disse pumper til at drive medicin ind i cellen som en ny medicinindtrængningsmekanisme."
Denne særlige transportør findes i mange bakterier. Overraskende nok, videnskabsmænd kender endnu ikke dens virkelige funktion i cellen. Mens det pumper antibiotika ud, det er ikke hovedtransportøren, der hjælper E. coli i antibiotikaresistens, og det er muligt, at det har andre formål, der stadig er uopdagede. De har kun fundet ud af, at det transporterer et stort antal molekyler fra farvestoffer til antibiotika.
"Bakterier er konstant i krig med hinanden, så måske spiller det en rolle i lægemiddelresistens, " siger Henzler-Wildman. "Men den kan også transportere noget andet, vi ikke har testet, eller måske virker det i pH-resistens. Vi har ikke indsnævret det endnu."
Traditionelt, den model, der blev brugt til at beskrive denne transportør, var "den rene udvekslingsmodel, "som krævede de strenge, regimenteret bevægelse af protoner og lægemidlet i modsatte retninger. Imidlertid, virkeligheden af denne proces følger mantraet om "livet er rodet."
Henzler-Wildman foreslår en ny model kaldet "fri-udvekslingsmodellen, "hvor kombinationerne og transportretningen er meget mere fleksible med mange flere muligheder end tidligere antaget. De brugte magnetiske resonansdata til at visualisere disse specifikke og hidtil ukendte bevægelser af transportøren. Derefter undersøgte de, hvordan transporteren præcist reagerer i reagensglasset, når , for eksempel, det er udsat for antibiotika, for at bekræfte, at det fungerer, som strukturerne viste.
"At skulle omarbejde modellen og i det væsentlige omskrive lærebogen om, hvad vi vidste om transportørerne, vil virkelig ændre den måde, vi tænker på, " siger hun. "Jeg har faktisk tænkt mig at undervise i dette papir i vores intro-kandidatkursus, fordi det er så god en historie om, hvordan det at have en model i dit hoved kan begrænse din tænkning og eksperimenter, og du virkelig går glip af vigtige ting."
 Varme artikler
Varme artikler
-
 Geopolymerbeton:Bygning af månebaser med astronauturin og regolitFremtidige månebaser kunne bygges med 3D-printere, der blander materialer såsom måneregolith, vand og astronauters urin Kredit:ESA, Foster og partnere De moduler, som de store rumorganisationer pl
Geopolymerbeton:Bygning af månebaser med astronauturin og regolitFremtidige månebaser kunne bygges med 3D-printere, der blander materialer såsom måneregolith, vand og astronauters urin Kredit:ESA, Foster og partnere De moduler, som de store rumorganisationer pl -
 Tager gætværket ud af retsmedicinsk analyse af fingermærkerForskere bruger infrarøde lasere til at løfte fingeraftryk fra gerningssteder. Kredit:LSU Forskere ved Louisiana State University Department of Chemistry, herunder postdoc-forsker Fabrizio Donnaru
Tager gætværket ud af retsmedicinsk analyse af fingermærkerForskere bruger infrarøde lasere til at løfte fingeraftryk fra gerningssteder. Kredit:LSU Forskere ved Louisiana State University Department of Chemistry, herunder postdoc-forsker Fabrizio Donnaru -
 Nyt atlas med lipidform er nøglen til tidlig sygdomsdetektionLipidatlasset bygget af Vanderbilt University kemikere kan tilføjes, når andre forskere begynder at afkode molekyleformer. Kredit:The McLean Group Hver en smule information om en persons helbred -
Nyt atlas med lipidform er nøglen til tidlig sygdomsdetektionLipidatlasset bygget af Vanderbilt University kemikere kan tilføjes, når andre forskere begynder at afkode molekyleformer. Kredit:The McLean Group Hver en smule information om en persons helbred - -
 Nyudviklet molekyle til forbedring af lægemidler henter inspiration fra naturens værktøjskasseKredit:Colorado State University I kapløbet om at skabe mere potente og stabile lægemidler, videnskabsmænd ved, at tilsætning af fluor kan forbedre lægemiddelmolekyler. Imidlertid, der er kun én
Nyudviklet molekyle til forbedring af lægemidler henter inspiration fra naturens værktøjskasseKredit:Colorado State University I kapløbet om at skabe mere potente og stabile lægemidler, videnskabsmænd ved, at tilsætning af fluor kan forbedre lægemiddelmolekyler. Imidlertid, der er kun én
- Microsoft og Amazon viser, at Cortana og Alexa kan tale med hinanden, i hvert fald på scenen til Bu…
- Hvad er et magnetometer?
- Instrument øger analyse af små, ekstremt mørke materialer
- Forskere finder bly i gurkemeje
- Hvorfor tungen på Pine Island Glacier pludselig krympede
- Ny forskning finder, at 1 mio. Dødsfald i 2017 skyldes forbrænding af fossilt brændsel


