De lette kæde-underenheder af terapeutiske antistoffer påvirker lægemidlets ydeevne og udbytte
Antistofbaserede lægemidler har længe været en grundpille i behandlingen af mange tilstande, især kræft og autoimmune sygdomme, men der kan stadig være plads til at forbedre disse terapier. En A*STAR-undersøgelse har fundet ud af, at ændringer i en del af antistofferne, som ofte overses af proteiningeniører og medicinalfirmaer, kan have dramatiske effekter på målbinding og produktionsudbytte.
Et antistof er opbygget af fire polypeptidkæder:to 'tunge' kæder danner molekylets Y-form, og to 'lette' kæder sidder ved siden af dem. Til dato, de fleste af modifikationsteknikkerne i terapeutisk antistofdesign har fokuseret på de tunge kæder. De lette kæder blev generelt betragtet som mindre vigtige, selvom det er blevet påvist, at de også er involveret i at binde målmolekyler, og at "ramme"-regionerne af lette kæder giver strukturel støtte for at tillade målkontakt.
For at evaluere vigtigheden af den lette kæde i antistofydelsen, et hold ledet af Samuel Ken-En Gan fra A*STAR Bioinformatics Institute og p53 Laboratory slettede to aminosyrer i rammeregionen af den lette kæde af trastuzumab, et antistoflægemiddel til behandling af brystkræft, sælges under varemærket Herceptin. Enten sletning af sig selv, fandt forskerne, førte til en reduktion i antistofsekretion fra et rekombinant cellekultursystem, selvom det ikke i alvorlig grad påvirkede trastuzumabs evne til at binde sit mål, et protein kaldet human epidermal vækstfaktor receptor 2 (Her2). Slet begge aminosyrer, imidlertid, og både antistofproduktion og Her2-binding faldt signifikant.
Strukturel modellering og eksperimenter udført af medlemmer af Gans antistofprodukt- og udviklingslaboratorium, herunder co-first forfattere Chinh Tran-To Su og Wei-Li Ling, afslørede, at deletionerne svækkede interaktionen mellem trastuzumab og et protein, der blev brugt til antistofoprensning. Det forklarer udbyttereduktionen, mens nedsat affinitet for Her2 forklarer, hvorfor deletionerne også hindrer antistofydelsen.
"Denne undersøgelse viser, at den lette kæde og dens rammeregioner kan påvirke nøglefaktorer for et godt terapeutisk antistof, selv på steder, der ikke vides at være direkte involveret i binding eller oprensning, " han siger.
Selvom disse første fund kun viser de negative konsekvenser af at ændre et antistofs lette kæde, Gan og hans team, i endnu ikke offentliggjort arbejde, har også fundet måder at forbedre både produktion og målbinding gennem andre let kæde modifikationer. "Dette er kun det første i en serie af artikler fra mit laboratorium, der viser, at vi skal betragte antistoffet som en helhed og ikke kun som en sum af forskellige dele, " siger Gan.
 Varme artikler
Varme artikler
-
 Video:Chemtrails vs. contrailsKredit:The American Chemical Society Det er let at se på det hvide spor bag et jetfly og forestille sig alle former for kemikalier, der regner ned ovenfra. Imidlertid, flyindstyr er simpelthen det
Video:Chemtrails vs. contrailsKredit:The American Chemical Society Det er let at se på det hvide spor bag et jetfly og forestille sig alle former for kemikalier, der regner ned ovenfra. Imidlertid, flyindstyr er simpelthen det -
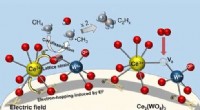 Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko
Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko -
 Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af
Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af -
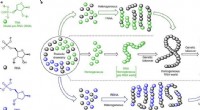 Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt:
Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt:


