Elastisk inkohærent neutronspredning ved ILL udfordrer Lindemann-kriteriet i proteiner
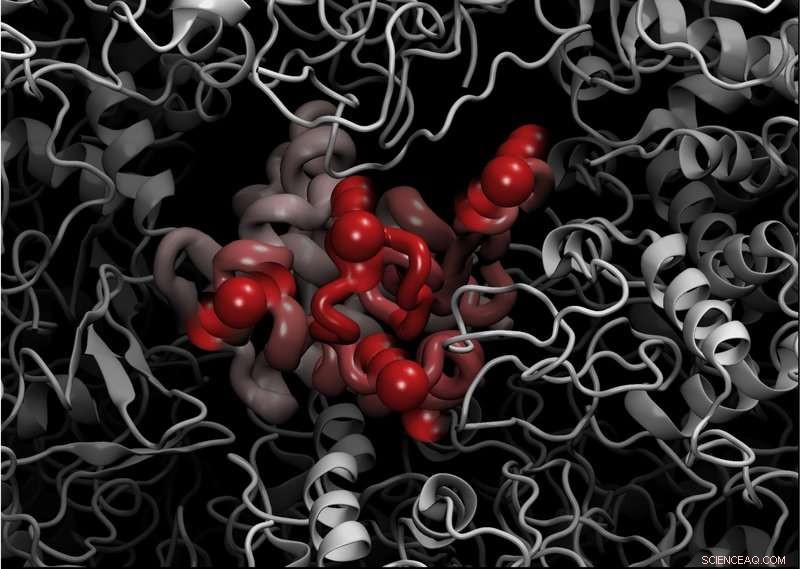
Et billede af lysozymproteinet, mens det smelter
Proteiner er de nanomaskiner, som naturen bruger til at udføre de fleste af de processer, der er kritiske for metabolismen i celler. Et af hovedmålene for livs- og fysiske videnskaber drejer sig om at forstå den indfødtes strukturelle og dynamiske egenskaber, overgang, mellemliggende, og denaturerede tilstande af proteiner. Denatureringsovergangen - defineret som overgangen af proteiner fra deres specifikke native funktionelle tilstand til den udfoldede inoperative tilstand - er af særlig interesse, da det definerer grænserne for stabilitet og funktionalitet af fasediagrammet af proteiner.
Interne subnanosekunders tidsskalabevægelser er også nøglen til proteinfoldning - uden kunne disse proteiner ikke engang folde i deres native struktur. Desuden, de er ekstremt følsomme over for mængden og beskaffenheden af opløsningsmidlet, der omgiver proteinoverfladen, dvs. både amplituden og hastigheden af disse dynamikker kan reduceres kraftigt, når proteiner er indlejret i sukker-glas-matricer.
Selvom videnskaben ved, at disse hurtige udsving styrer proteinkonformationsændringer, deres rolle for proteinstabilitet og udfoldelse er stadig uhåndgribelig.
Resultaterne af en ny undersøgelse udført ved Institut Laue-Langevin (ILL), gennem et samarbejde mellem CNRS' Laboratoire de Biochimie Théorique (Frankrig), universiteterne i Perugia, Pisa og Verona (Italien) og CNR (Italien), gav et fornyet billede af Lindemann-kriteriet. Når man udfører eksperimenter med elastisk neutronspredning, forskere fandt en fælles skalering mod en konstant værdi for de lokale fluktuationer af et modelprotein i forskellige miljøer, når man nærmer sig udfoldelsestemperaturen.
Ved at bruge de avancerede instrumenter på ILL, nemlig backscattering-spektrometeret med bredt Q-område IN13, forskerne udførte elastiske usammenhængende neutronspredningsforsøg på lysozymproteinet, hønseæggehvide lysozym (CEWL) i nærværelse af forskellige perdeurerede matricer (D20, glycerol, og glukose). Dette gjorde det muligt for dem at studere modelproteinets sub-nanosekunders tidsskaladynamik i overensstemmelse med den udfoldede overgang.
Denne eksperimentelle teknik er meget følsom over for bevægelser af brintatomer, og velegnet til at udforske proteinbevægelser på en pico til nano tidsskala. Det giver præcise kvantitative målinger af amplituden af proteinets indre bevægelser i form af hydrogen-middel-kvadratforskydninger (MSD).
Ved at kombinere elastisk inkohærent neutronspredning og avancerede simuleringer af molekylær dynamik, de viste det, selvom forskellige opløsningsmidler modificerer proteinets smeltetemperatur, et unikt dynamisk regime opnås, når det er tæt på termisk udfoldning i alle testede opløsningsmidler.
Dette minder om det berømte Lindemann-kriterium, der blev indført i 1910, hvor F.A. Lindemann udviklede et praktisk kriterium til at forudsige krystallers smeltetemperatur. Desuden, analogien mellem smeltning af uorganiske krystaller og native biomolekyler antyder, at disse tilsyneladende meget forskellige systemer kan dele adfærd i tilsvarende faseovergange.
Den almindelige skalering for proteinet MSD ved smeltepunktet kaster ikke kun lys over forholdet mellem proteinfleksibilitet og stabilitet, men åbner også muligheden for at forudsige proteinudfoldelse i specielle miljøer (f.eks. cellens indre) ved at følge termisk, lokale udsving.
Kriteriet de foreslår kan også anvendes til at undersøge det temperaturområde, hvor mikroorganismer trives f.eks. ved ekstreme temperatur- og trykforhold i dybhavet eller endda i rummet.
Denne forskning lægger potentielt grundlaget for en dybere forståelse af foldning og udfoldning af proteiner, som er afgørende processer i metabolismen af celler, regulering af biologisk aktivitet og målretning af proteiner til forskellige cellulære lokaliteter.
Derudover at forstå funktionerne af proteindynamik er nøglen til bioteknologi og farmaceutiske industrier, hvor terapeutiske principper baseret på proteiner er værd omkring 30 milliarder dollars alene på det amerikanske marked.
 Varme artikler
Varme artikler
-
 Hydrogelcoating er den første til at forhindre isdannelse på 3 forskellige måderBelægningen kunne være en billig løsning til at forhindre udendørs rør, flyvingekomponenter og andet udstyr fra at fryse i kolde temperaturer. Kredit:iStock.com/fotograff Materialeforskere ved UCL
Hydrogelcoating er den første til at forhindre isdannelse på 3 forskellige måderBelægningen kunne være en billig løsning til at forhindre udendørs rør, flyvingekomponenter og andet udstyr fra at fryse i kolde temperaturer. Kredit:iStock.com/fotograff Materialeforskere ved UCL -
 Forskellene mellem salt og sukkerSelvom sukker og salt kan se lignende ud, er de ganske forskellige. Forskellige sukkerarter forekommer naturligt, men udtrykket sukker henviser normalt til saccharose, som er et disaccharid lavet a
Forskellene mellem salt og sukkerSelvom sukker og salt kan se lignende ud, er de ganske forskellige. Forskellige sukkerarter forekommer naturligt, men udtrykket sukker henviser normalt til saccharose, som er et disaccharid lavet a -
 At skabe attraktion mellem molekyler dybt i det periodiske systemKredit:CC0 Public Domain Et McGill-ledet internationalt forskerhold giver det første eksperimentelle og teoretiske bevis på, at det er muligt at danne stærke, stabile attraktioner mellem nogle af
At skabe attraktion mellem molekyler dybt i det periodiske systemKredit:CC0 Public Domain Et McGill-ledet internationalt forskerhold giver det første eksperimentelle og teoretiske bevis på, at det er muligt at danne stærke, stabile attraktioner mellem nogle af -
 Forskere udvikler guldkompleksbundne ferrocenylphosphiner som potente malariamidlerGuldkonjugerede ferrocinylphosphiner, der hæmmer fordøjelsesvakuolefunktionen af malariaparasitten, Plasmodium falciparum. Kredit:SUTD Et team af forskere fra Singapore University of Technology
Forskere udvikler guldkompleksbundne ferrocenylphosphiner som potente malariamidlerGuldkonjugerede ferrocinylphosphiner, der hæmmer fordøjelsesvakuolefunktionen af malariaparasitten, Plasmodium falciparum. Kredit:SUTD Et team af forskere fra Singapore University of Technology
- Sikkerhedsproblemer fundet i 5G -protokollen
- For at bekæmpe arbejdsløshed, Irakisk ungdomsplante opstartsfrø
- Fugtresponsive robotter gennemsøger uden ekstern strømkilde
- Overbrug af landbrugskemikalier på små gårde i Kina skader sundhed og miljø
- Sydkorea vil bøde BMW på 10 mio. USD for reaktion på motorbrande
- Galilæas vandstand laveste i århundrede


