Forskning finder et godt sted til at udvikle bedre cellulosenedbrydende enzymer

Postdoc-forsker Antonella Amore og senioringeniør Brandon Knott arbejder på prøver i laboratoriet. Den nye forskning om forholdet mellem små sukkerarter (glykaner), deres funktion, og deres placering kunne bruges til at forbedre enzymydelsen for bedre at nedbryde biomasse og omdanne affaldsanlæg til vedvarende brændstoffer og produkter. Kredit:Dennis Schroeder/NREL
Forskere fra U.S. Department of Energy's (DOE) National Renewable Energy Laboratory (NREL) har fået ny indsigt i, hvordan glycosylering - den naturlige binding af sukker til proteiner - påvirker et centralt cellulaseenzym. Dette arbejde kan bruges til at forbedre enzymets ydeevne for bedre at nedbryde biomasse og omdanne affaldsplantemateriale til vedvarende brændstoffer og produkter. Nemlig jo mere effektivt enzymet er, jo mere effektiv og økonomisk vil processen være.
Den nye forskning, som fokuserer på enzymet Cel7A, der nedbryder cellulose i planter til sukkerarter, er detaljeret i Proceedings of the National Academy of Sciences ( PNAS ) i et manuskript med titlen "Særskilte roller for N- og O-glycaner i cellulaseaktivitet og stabilitet." Denne undersøgelse belyser de specifikke funktioner af små sukkerarter, eller glykaner, som mikrober fæstner til deres enzymer. Denne enzymatiske modifikation ved tilsætning af sukker kaldes "glycosylering", og det er kendt at have en betydelig indvirkning på enzymfunktionen.
En kvinde og en mand arbejder ved en laboratoriebænk omgivet af laboratorieudstyr.
Postdoktor Antonella Amore og senioringeniør Brandon Knott arbejder på prøver i laboratoriet. Den nye forskning om forholdet mellem små sukkerarter (glycaner), deres funktion, og deres placering kunne bruges til at forbedre enzymets ydeevne for bedre at nedbryde biomasse og omdanne affaldsanlæg til vedvarende brændstoffer og produkter. (Foto:Dennis Schroeder/NREL)
"Enzymer til nedbrydning af cellulose er notorisk vanskelige at konstruere til forbedret aktivitet, " sagde NREL stabsingeniør Brandon Knott, medforfatter til papiret. "Det er længe blevet erkendt, at glykosylering er en 'drejeknap' i dette forsøg, men de forskellige glykaners specifikke roller har været undvigende."
Med usikkerhed omkring, hvordan de forskellige slags glykaner relaterer sig til forskellige enzymfunktioner, NREL udviklede et unikt rekombinant ekspressionssystem til test af nye enzymer, producerer en stor samling af Cel7A -mutanter, der manglede forskellige kombinationer af glycosyleringssteder. Et team af forskere fra NREL, University of Georgia, og University of Colorado, Kampesten, karakteriserede derefter alle de mutante enzymer og sammenlignede funktionerne med dem i det native enzym for at indsamle kritiske data om forholdet mellem den specifikke glycan, dens funktion, og dens placering.
"Baseret på litteraturen, vi troede allerede, at vi kendte placeringen af alle glykosyleringssteder, " sagde medforfatter Antonella Amore, en postdoktor ved NREL. "Ved at bekræfte deres placeringer, vi opdagede ikke kun nye glykaner, vi har også belyst strukturerne af glycanerne på hvert specifikt sted. Dette giver indsigt i, hvordan mikroben beskytter og dekorerer sine enzymer for optimal aktivitet, som igen giver fingerpeg om, hvordan man kan forbedre dem til industrielle applikationer."
At få en dybere forståelse af den grundlæggende struktur, fungere, og forbindelser mellem proteiner er grundlæggende for at hjælpe med at designe nye strategier til forbedring af den samlede enzymydelse. Men at bygge et overlegen enzym kræver en forståelse af en enorm kombination af faktorer. Det er vigtigt at vide, hvilke glykaner der beskytter mod proteaseangreb, hvilke er afgørende for binding til enzymstabilitet, og som er nøglen til enzymbinding og aktivitet. NRELs resultater har afsløret, at afhængigt af dens type og hvor den er fastgjort, glykosylering er vigtig for at styrke bindingen af Cel7A til cellulose, beskytter enzymet mod proteaser, der nedbryder proteinet, og styrkelse af enzymets termiske stabilitet, som gør det muligt for enzymet at fortsætte med at arbejde ved temperaturer, der ville blive mødt i en industriel biomasseomdannelsesproces.
 Varme artikler
Varme artikler
-
 Jo langsommere de drejer, jo lysere lyser deKobberkompleksernes fotoluminescensevne øges, når deres molekylære struktur øges. Efterhånden som kobberkomplekser bliver større i strukturen (øger fra venstre mod højre), deres bevægelser bremses. De
Jo langsommere de drejer, jo lysere lyser deKobberkompleksernes fotoluminescensevne øges, når deres molekylære struktur øges. Efterhånden som kobberkomplekser bliver større i strukturen (øger fra venstre mod højre), deres bevægelser bremses. De -
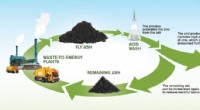 Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa;
Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa; -
 Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra
Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra -
 Insekter inspirerer grønnere, billigere membraner til afsaltningMembranens porer fanger luft ved nedsænkning i vand, adskiller væskerne på begge sider og tillader kun transport af ren vanddamp fra den varme til den kolde side. Kredit:Ivan Gromicho En ny membra
Insekter inspirerer grønnere, billigere membraner til afsaltningMembranens porer fanger luft ved nedsænkning i vand, adskiller væskerne på begge sider og tillader kun transport af ren vanddamp fra den varme til den kolde side. Kredit:Ivan Gromicho En ny membra


