Enzymer og bakterier bevæger sig retningsbestemt, men bakterier mod mad, enzymer væk
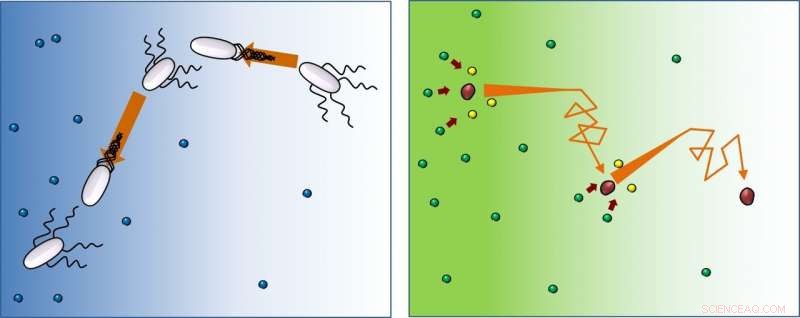
I nærværelse af mad (blå), bakterier (hvide) svømmer ligeud, skift derefter retning (tumle), og følg dette mønster igen og igen. Denne undersøgelse viser, at enzymer (røde) bevæger sig på samme måde, men efter at have reageret med substrater (fra grøn til gul), de fortsætter med at løbe-og-tumle væk fra den højere koncentration af substrater. Kredit:IBS
Selvom det kan virke som et sammenstød at sammensætte ordene "tilfældig" og "biased" det er de egenskaber, der beskriver, hvordan bakterier navigerer og henter deres mad. De følger en tilfældig vej, men forspændt i retningen af næringsstoffernes kilde. Forskere ved Center for blødt og levende stof, inden for Institut for Grundvidenskab (IBS, Sydkorea), observeret, at enzymer, de molekyler, der hjælper biologiske reaktioner med at ske hurtigere, bevæge sig med et lignende mønster, men i den modsatte rute - tilfældigt rejser mod området med færre substrater. Disse resultater, opnået med nye optiske teknologier og udgivet som en åbningsartikel i Proceedings of the National Academy of Sciences (PNAS) , er særligt spændende, da de udgør en afvigelse fra den traditionelle opfattelse.
Tusindvis af enzymer fremmer et væld af reaktioner i vores kroppe, som hver især opretholder vores liv. Enzymer virker på andre kemikalier kaldet substrater og fremskynder kemiske reaktioner, der omdanner substrater til produkter. At gøre det, enzymer og substrater skal mødes. Det blev oprindeligt antaget, at enzymer og deres korresponderende substrater tilfældigt støder ind i hinanden:"Standard lærebøger nævner, at enzymer og substrater formodes at komme tæt på 'på en eller anden måde' "interagere, og det er sådan reaktioner sker. Vi forsøgte at grave ind i "på en eller anden måde" del af denne proces. Efter at have indsamlet tusindvis af begivenheder konkluderede vi, at enzymernes gang er tilfældigt forudindtaget, hvilket betyder, at de er mikroskopisk retningsbestemte, som bakterier, " forklarer Ah-Young Jee, første forfatter til denne undersøgelse.
Svømmebakteriers bevægelse er kendt som "løb-og-tumle":løb, vend og gentag. De går i én retning, skift derefter retning tilfældigt, og gentag. Imidlertid, mens bakterier orienterer sig mod fødeforsyningen, enzymer bevæger sig i retning af mindre substratkoncentration. "Molekyler mangler beslutningsevner, men bevæger sig overraskende mod områder med mindre substrat. Ja, substratet introducerer retningsbias, og jo højere substratkoncentration vi brugte i eksperimentet, jo stærkere denne tendens. Vi antager, at det kunne være en måde at gøre produktkoncentrationen ensartet omkring mediet, selv når substratkoncentrationen ikke er, " siger prof. Tsvi Tlusty, som tilbød den teoretiske forståelse af denne forskning.
Da hvert enzyms skridt kun er omkring 50 nanometer langt, ekstremt præcise enheder er nødvendige for at måle deres hastighed og orientering. Forskerholdet, ledet af Steve Granick, så på den enzymatiske bevægelse med en superopløsningsmikroskopiteknologi, kendt som stimuleret emission-depletion fluorescens-korrelationsspektroskopi, eller STED-FCS for kort.

A) Enzym-substrat-buffer (E+S+B) kommer ind i venstre indløb, og enzym-buffer (E+B) injiceres til højre indløb. På denne måde enzymkoncentrationen er ensartet over hele chippen, mens substratkoncentrationen er højere i venstre side (blå) gradvist aftagende mod højre (hvid). De stiplede rektangler angiver det område, hvor enzymbevægelsen studeres meget detaljeret ved hjælp af STED-FCS mikroskopiteknologi. B) Koncentrationen af enzymet urease (sort) og koncentrationen af urinstof (dets substrat, grå) er plottet mod positionen inden for FCS-zonen, mellem 0 og 2,5 millimeter fra laserstrålen. Skalaen ved hvert punkt er en fejlbjælke, viser standardafvigelsen over fem gentagne målinger. C) Diffusionskoefficienten (Da), som angiver, hvor hurtigt enzymet bevæger sig, ændres ikke i fravær af substrat, men det øges, når substratet er til stede, hvilket betyder, at enzymet bevæger sig hurtigere til højre. Kredit:IBS, udgiver i PNAS
I FCS-metoden, enzymer er dekoreret med fluorescerende molekyler, og deres passage gennem en lille prik detekteres af en laserstråle. Der indsamles statistiske oplysninger, såsom antallet af enzymer, der passerer gennem prikken og deres hastighed (diffusionshastighed). Holdet supplerede FCS med STED-teknologi, en af styrkerne ved dette forskningscenter. STED koncentrerer laserstrålen til et ekstremt lille område, tillader en mere raffineret måling af enzymernes position. FCS laserstrålen dækker et område på omkring 250 nanometer i diameter, hvilket er cirka 25 gange enzymets diameter (10 nanometer). STED-FCS er mere nøjagtig, da den reducerer strålediameteren til 50 nanometer, hvilket er sammenligneligt med afstanden af et enzyms trin.
Forskerne designet også en ny mikrofluidikchip, dannet af mikrometertykke kanaler, hvor væsker kan passere igennem. Tidligere undersøgelser, ved at bruge FCS uden STED og en anden mikrofluidchip, foreslog, at enzymerne bevæger sig mod området med den højeste koncentration af substrat. Imidlertid, denne nye teknologi tillader dybere observationer og viste det modsatte. Forfatterne mener, at resultaterne adskiller sig, fordi detaljerede oplysninger om enzymbevægelsen blev annulleret ved hjælp af en større laserstråle. Det ville svare til at lokalisere nogen inden for 50 kvadratkilometer eller inden for 2 kvadratkilometer, sidstnævnte er mere nøjagtig. De skabte forhold, hvor enzymet er ensartet fordelt inde i chippen, men substratkoncentrationen varierer fra venstre til højre:fra en minimumskoncentration på højre side af chippen, til en maksimal koncentration til venstre. Derefter, de brugte FCS til at observere enzymets koncentration og hastighed inde i chippen, og fandt ud af, at enzymet har en tendens til at accelerere mod området med mindre substratkoncentration (det vil sige mod højre side af chippen). I stedet, når der ikke er noget substrat til stede, enzymerne ændrer ikke deres hastighed. I øvrigt, STED-FCS's superopløsningsevner viste løb-og-tumle-dynamik.
Holdet observerede den samme adfærd med to enzym-substrat-par hver for sig:urease-urea og acetylcholinesterase (AChE)-acetylcholin. Det førstnævnte enzym bruges af nogle mikroorganismer til at omdanne urinstof til ammoniak og kulsyre, sidstnævnte spiller en væsentlig rolle i neuromuskulære forbindelser.
I fremtiden, forskerholdet sigter mod at udvide kompleksiteten af undersøgelsen og teste betingelser mere lig det virkelige liv:"Denne undersøgelse så på adfærden af et enzym som reaktion på et substrat. Dernæst, vi planlægger at se på flere enzymer på samme tid. Vores krop fungerer med en kaskade af reaktioner, hvilket betyder, at en reaktion udløser den næste:enzym A udløser enzym B, så udløser B C, og så videre. STED-FCS-analyse kunne være et nøgleværktøj til at fremme metabolisk forskning ved at afsløre, hvordan disse multiple enzymsystemer er organisk relaterede, " slutter Jee.
Sidste artikelVideo:Sådan spotter du falske metaller med syrer
Næste artikelSporing af en løsningsproces trin for trin
 Varme artikler
Varme artikler
-
 Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat
Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat -
 Sjove eksperimenter til at adskille blandingerDet er chancen, at du ofte adskiller blandinger. For eksempel, når du adskiller tøjvask eller vælger en topping fra en pizza eller dræner en batch med frisk kogt pasta, adskiller du en blanding. En bl
Sjove eksperimenter til at adskille blandingerDet er chancen, at du ofte adskiller blandinger. For eksempel, når du adskiller tøjvask eller vælger en topping fra en pizza eller dræner en batch med frisk kogt pasta, adskiller du en blanding. En bl -
 Opbygning af OLED'er fra bunden for bedre elektronikOrganic light emitting diode (OLED)-arrays genereret i opløsning kan overvinde mange fremstillingsudfordringer. Kredit:Zak Page Fra smartphones til tver og bærbare computere, lysemitterende diode
Opbygning af OLED'er fra bunden for bedre elektronikOrganic light emitting diode (OLED)-arrays genereret i opløsning kan overvinde mange fremstillingsudfordringer. Kredit:Zak Page Fra smartphones til tver og bærbare computere, lysemitterende diode -
 Kemikere udvikler urinprøve med papirstrimmel til evaluering derhjemme/på kontoret/klinikkenRobbyn Anand og studerende i hendes forskningsgruppe udvikler en ny papirstrimletest for at opdage coronavirus, der forårsager COVID-19. Kredit:College of Liberal Arts and Sciences Kemikere ved Io
Kemikere udvikler urinprøve med papirstrimmel til evaluering derhjemme/på kontoret/klinikkenRobbyn Anand og studerende i hendes forskningsgruppe udvikler en ny papirstrimletest for at opdage coronavirus, der forårsager COVID-19. Kredit:College of Liberal Arts and Sciences Kemikere ved Io
- Er livets oprindelse bare kosmisk støv i vinden?
- Hyppige vækstbegivenheder og hurtige vækstrater for fine aerosolpartikler i Beijing
- Entropyproduktion får en systemopdatering
- Sådan kommer du i avanceret matematik i den sjette klasse
- Forskere fandt og studerede komplekse typer defekter i dråberne af flydende krystaller
- Mauna Loa Fakta for Kids


