Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydning
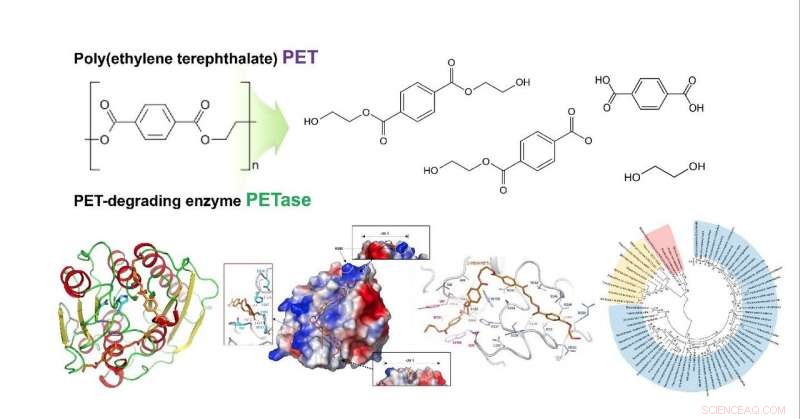
Strukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST
Et KAIST metabolisk ingeniørundersøgelsesteam har fundet en molekylær mekanisme, der viser overlegen nedbrydelighed af polyethylenterephthalat (PET). Dette er den første rapport for at bestemme 3D-krystalstrukturen af Ideonella sakaiensis PETase og udvikle den nye variant med forbedret PET-nedbrydning.
Forskningsprojekter har arbejdet på at løse materialers ikke-nedbrydelighed. En polyethylenterephthalat (PET) -nedbrydende bakterie kaldet Ideonella sakaiensis blev for nylig identificeret for mulig nedbrydning og genbrug af PET af et japansk team, der offentliggjorde resultater i Videnskab i 2016. Dog er den detaljerede molekylære mekanisme for PET -nedbrydning blev ikke bestemt.
Teamet ledet af professor Sang Yup Lee fra Institut for Kemisk og Biomolekylær Teknik og et andet teamhold ledet af professor Kyung-Jin Kim fra Institut for Bioteknologi ved Kyungpook National University gennemførte denne forskning. Resultaterne blev offentliggjort i Naturkommunikation den 26. januar.
Denne forskning forudsiger en særlig molekylær mekanisme baseret på dockingsimuleringen mellem PETase og et PET -alternativt efterlignende substrat. De konstruerede varianten til IsPETase med forbedret PET-nedbrydende aktivitet ved hjælp af strukturbaseret proteinteknik.
Det forventes, at de nye tilgange i denne forskning kan bidrage til yderligere undersøgelse af andre enzymer, der ikke kun kan nedbryde PET, men anden plast, såvel.
Efter brug, PET forårsager miljøforureningsproblemer på grund af dets ikke-biologiske nedbrydelighed. Konventionelt, PET bortskaffes på lossepladser, ved hjælp af forbrænding, og nogle gange genbrug ved hjælp af kemiske metoder, hvilket fremkalder yderligere miljøforurening. Derfor, højeffektive PET-nedbrydende enzymer og biobaserede, miljøvenlige metoder er ønskelige.
For nylig, forskere isolerede en ny bakterieart, Ideonella sakaiensis, som kan bruge PET som en kulstofkilde. PETase af I. sakaiensis (IsPETase) kan nedbryde PET med relativt højere succes end andre PET-nedbrydende enzymer. Imidlertid, den detaljerede enzymmekanisme er ikke blevet belyst, hindrer yderligere studier.
Forskergrupperne undersøgte, hvordan substratet binder sig til enzymet, og hvilke forskelle i enzymstrukturen resulterer i betydeligt højere PET -nedbrydende aktivitet sammenlignet med andre cutinaser og esteraser. Baseret på 3D-strukturen og relaterede biokemiske undersøgelser, de fastslog med succes grundlaget for PET -nedbrydende aktivitet af IsPETase og foreslog andre enzymer, der kan nedbryde PET med et nyt fylogenetisk træ. Teamet foreslog, at 4 MHET-grupper er de mest passende matchede substrater på grund af en strukturel kløft, selv med 10-20-mere for PET. Dette er meningsfuldt, idet det er den første dockingsimulering mellem PETase og PET, ikke dens monomer.
Desuden, det lykkedes dem at udvikle en ny variant med meget højere PET-nedbrydende aktivitet ved hjælp af en krystalstruktur af denne variant for at vise, at den ændrede struktur bedre rummer PET-substrater end vildtype PETase, hvilket vil føre til overlegen enzymudvikling og platformskonstruktion til genanvendelse af mikrobiel plast.
Professor Lee sagde, "Miljøforurening fra plast er fortsat en af de største udfordringer på verdensplan med det stigende forbrug af plast. Vi har med succes konstrueret en ny, overlegen PET-nedbrydende variant med bestemmelse af en krystalstruktur af PETase og dens nedbrydende molekylære mekanisme. Denne nye teknologi vil hjælpe yderligere undersøgelser med at konstruere mere overlegne enzymer med høj effektivitet ved nedbrydning. "
Sidste artikelForbedring af følsomheden for ioniske opløste analyser
Næste artikelVideo:Gallium og historien om det periodiske system
 Varme artikler
Varme artikler
-
 Krystallisering blev krystalklarKorrelation mellem cryo-transmission elektronmikroskop (TEM) billeder og krystalstrukturen. a) TEM -billede, der viser tre kolliderende klynger. Skalaen er 10 nm. b) Relative positioner af molekyler a
Krystallisering blev krystalklarKorrelation mellem cryo-transmission elektronmikroskop (TEM) billeder og krystalstrukturen. a) TEM -billede, der viser tre kolliderende klynger. Skalaen er 10 nm. b) Relative positioner af molekyler a -
 Et biobrændstof til automatiseret varmeproduktionArkadievsky tørv i Tomsk Oblast i Sibirien, Rusland. Kredit:Tomsk Polytekniske Universitet Pyrolyse, en proces med nedbrydning af biomasse, kan organiseres automatisk. Specifikt, det er tilstrække
Et biobrændstof til automatiseret varmeproduktionArkadievsky tørv i Tomsk Oblast i Sibirien, Rusland. Kredit:Tomsk Polytekniske Universitet Pyrolyse, en proces med nedbrydning af biomasse, kan organiseres automatisk. Specifikt, det er tilstrække -
 Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill
Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill -
 Ladningsoverførsel inden for overgangsmetalfarvestoffer analyseretEn røntgenimpuls sonderer delokaliseringen af jern-3d-elektroner på tilstødende ligander. Kredit:M. Künsting/HZB Overgangsmetalkomplekser i farvestofbaserede solceller er ansvarlige for at omdan
Ladningsoverførsel inden for overgangsmetalfarvestoffer analyseretEn røntgenimpuls sonderer delokaliseringen af jern-3d-elektroner på tilstødende ligander. Kredit:M. Künsting/HZB Overgangsmetalkomplekser i farvestofbaserede solceller er ansvarlige for at omdan
- Optiske egenskaber ved todimensionale materialer til potentielle fremskridt inden for infrarød tekn…
- Forstyrrer vulkaner atmosfæren?
- Verizon afslutter salget af datadata til mæglere
- Indonesias Lion air indstillet til at notere aktier
- Hollandske opfindere svampekister forvandler lig til kompost
- Hvordan Sydafrika kan forberede sig på et datadrevet uddannelsessystem


