Ny symmetri-brydende metode åbner vej for bioaktive forbindelser

En demonstration af molekylær chiralitet ved hjælp af 3-D atommodeller i laboratoriet. Kredit:J. Waser/EPFL
Mange kemiske molekyler kan eksistere i naturen sammen med deres spejlmodstykker; som hænder, to forbindelser kan bestå af de samme atomer i den samme overordnede struktur, men i modsatte retninger, dvs venstrehåndet og højrehåndet. Dette fænomen med symmetri kaldes "kiralitet", og kan give spejlmodstykker ("enantiomerer") helt forskellige kemiske egenskaber. Et berømt og tragisk eksempel på chiralitet er thalidomid, som oprindeligt blev solgt som en blanding af begge enantiomerer. Problemet var, at det ene var et harmløst beroligende middel og det andet meget giftigt for fostre, resulterer i forstyrrende medfødte deformiteter.
Så i dag er det blevet bydende nødvendigt at syntetisere forbindelser med det, der er kendt som høj "optisk renhed", som er en måling af chiral renhed:graden, i hvilken en prøve indeholder en enantiomer i større mængder end den anden. Men fordi enantiomerer har meget små strukturelle forskelle og identisk stabilitet, at syntetisere den ene over den anden er en meget udfordrende opgave.
En måde at gøre dette på er, hvad kemikere kalder "desymmetrization" af en ikke-chiral forbindelse, der ligner målmolekylet. Dette indebærer at modificere et molekyle, så det mister de symmetrielementer, der forhindrede det i at være chiralt.
Forskere ved Jérôme Wasers Laboratory of Catalysis and Organic Synthesis ved EPFL har nu udviklet en ny desymmetriseringsstrategi for at få adgang til chirale byggeklodser, der indeholder urea-understrukturer. Urinstofderivater er vigtige komponenter i biomolekyler såsom biotin (vitamin B7) eller bioaktive naturprodukter, såsom anticancer agelastatin A.
Forskerne lavede to afgørende innovationer. Først, de designede en ikke-chiral cyclopropan (treleddet carbonring) precursor. Dette molekyle tilbyder forbedret reaktivitet og er ideelt til reaktioner under milde forhold.
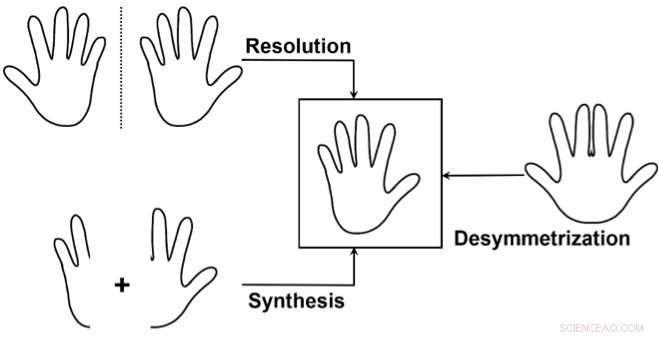
De tre hovedtilgange til selektiv adgang til en enantiomer:1) Adskil en blanding af de to enantiomerer (opløsning), spilder en af enantiomererne. 2) Syntetiser selektivt kun én af de to enantiomerer. 3) Brug en "desymmetrisering" af en ikke-chiral forbindelse svarende til målet. Dette bruges sjældnere, men det er særligt elegant, da det kan afsløre kiralitet fra en allerede relativt kompleks forløber ved at bryde symmetrien i kun en simpel transformation. Kredit:J. Waser/EPFL
Sekund, forskerne konstruerede en ny kobberkatalysator, der kan danne en enantiomer af det ønskede produkt med høj selektivitet. Kobbercentret binder og aktiverer cyclopropanprecursoren, får dets bånd til at bryde. Prækursoren angribes derefter af en indol, et molekyle meget vigtigt som strukturelt element i bioaktive forbindelser. Som resultat, precursoren mister sin symmetri - og bliver derfor chiral - og kan bruges til selektivt at fremstille den ønskede enantiomer.
Arbejdet er et vigtigt gennembrud, da desymmetriisering aldrig er blevet brugt til at få adgang til chirale urinstoffer fra cyclopropaner før. "Nye byggeklodser er nu let tilgængelige som rene enantiomerer, og kan testes for bioaktivitet eller bruges til at syntetisere mere komplekse chirale molekyler, " siger Jérôme Waser. "Desuden, den nye katalysator, vi har designet, vil helt sikkert være nyttig til andre anvendelser inden for syntetisk kemi."
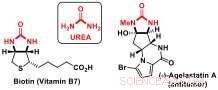
Urinstoffer:vigtige byggesten i bioaktive molekyler. Kredit:J. Waser/EPFL
 Varme artikler
Varme artikler
-
 Ser på molekyler fra to sider med femtosekund bløde røntgenstråler på bordpladenFlydende flatjet (solvatiseret urea) belyst af en bredbånds blød røntgenimpuls opnået ved højordens harmonisk generering. Indsætningerne viser steady-state absorptionen af urinstof ved C- og N K-kan
Ser på molekyler fra to sider med femtosekund bløde røntgenstråler på bordpladenFlydende flatjet (solvatiseret urea) belyst af en bredbånds blød røntgenimpuls opnået ved højordens harmonisk generering. Indsætningerne viser steady-state absorptionen af urinstof ved C- og N K-kan -
 Klæbende situation:Ny proces forvandler trærester til tapeIllustration, der repræsenterer transformationen af træer til tape. Ingeniører ved University of Delaware har udviklet en ny proces til at lave tape af en vigtig bestanddel af træer og planter kalde
Klæbende situation:Ny proces forvandler trærester til tapeIllustration, der repræsenterer transformationen af træer til tape. Ingeniører ved University of Delaware har udviklet en ny proces til at lave tape af en vigtig bestanddel af træer og planter kalde -
 Kraftige lasere til skrøbelige kunstværkerProfessor Patrizio Antici udfører et eksperiment på en gammel vase med den plasma-inducerede luminescensteknologi, som han udviklede. Kredit:INRS Tiden ændrer alle ting, skrev den latinske digter
Kraftige lasere til skrøbelige kunstværkerProfessor Patrizio Antici udfører et eksperiment på en gammel vase med den plasma-inducerede luminescensteknologi, som han udviklede. Kredit:INRS Tiden ændrer alle ting, skrev den latinske digter -
 Celsius vs CentigradeSkelnen mellem Celsius og celsius skalaer kan virke forvirrende - men de to udtryk henviser til samme målestok, og begge benytter samme gradbetegnelse - grader C. De to skalaer - - Centigrade og Cel
Celsius vs CentigradeSkelnen mellem Celsius og celsius skalaer kan virke forvirrende - men de to udtryk henviser til samme målestok, og begge benytter samme gradbetegnelse - grader C. De to skalaer - - Centigrade og Cel
- Sådan bygger du en model af et neon Atom
- Interessante fakta om Beaches
- De fleste mennesker overvejer at blive vegetarer for deres helbred
- Forskning giver nye resultater om lægemiddellevering med nanopartikler
- Endnu et skridt fremad på universel kvantecomputer
- Nanopartikler søger og ødelægger grundvandets toksiner


