Leder efter en afbryder til cøliaki
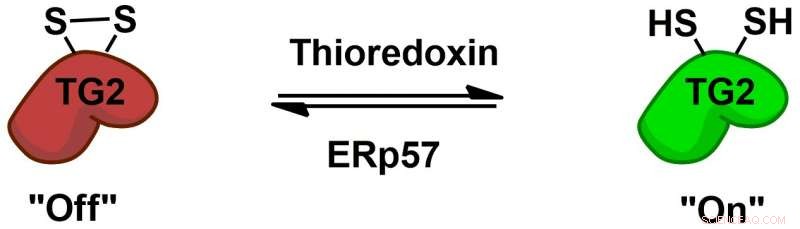
Transglutaminase 2 (TG2) reguleres reversibelt af proteincofaktorerne thioredoxin og ERp57 via en allosterisk disulfid redox switch. Kredit:Chaitan Khosla, Stanford University
Cøliaki er en autoimmun lidelse, der efter nogle skøn rammer næsten 1 ud af 100 mennesker. Cøliaki symptomer udløses af gluten, et protein, der findes i hvede og beslægtede planter, men gluten virker ikke alene for at forårsage de fordøjelsessymptomer, som patienter lider af. Hellere, gluten inducerer et overaktivt immunrespons, når det modificeres af enzymet transglutaminase 2, eller TG2, i tyndtarmen. Ny forskning offentliggjort i 23. februar-udgaven af Journal of Biological Chemistry identificerer et enzym, der slukker for TG2, potentielt bane vejen for nye behandlinger af cøliaki.
"I øjeblikket, terapier til behandling af mennesker med cøliaki mangler. Den bedste tilgang lige nu er blot en streng overholdelse af en livslang glutenfri diæt, " sagde Michael Yi, en kandidatstuderende i kemiingeniør ved Stanford University, der ledede det nye studie. "Måske er årsagen bag dette vores relativt dårlige forståelse af TG2."
Biokemien af, hvordan TG2 interagerer med gluten og inducerer et immunrespons, er blevet grundigt undersøgt, men mere grundlæggende mysterier er tilbage, for eksempel hvordan TG2 opfører sig hos mennesker uden cøliaki. Chaitan Khosla, professor ved Stanford og direktør for Stanford Chemistry, Engineering &Medicine for Human Health, der overvågede den nye undersøgelse, har udført flere undersøgelser, der viser, at TG2 kan være aktiv eller inaktiv, afhængig af dannelsen eller brydningen af en specifik kemisk binding, kaldet en disulfidbinding, mellem to aminosyrer i enzymet.
"(E) selvom der er meget transglutaminase 2-protein i (tyndtarmen), det hele er inaktivt, " sagde Khosla. "Da det blev klart, at selvom proteinet var rigeligt, dets aktivitet var ikke-eksisterende i et sundt organ, spørgsmålet blev 'Hvad tænder proteinet, og hvad slukker så for proteinet?'"I 2011, Khoslas team identificerede enzymet, der aktiverer TG2 ved at bryde dets disulfidbinding. I det nye blad, forskerne udførte eksperimenter i cellekulturer og fandt et enzym, der gendanner denne binding, inaktivering af TG2. Dette enzym, ERp57, er hovedsageligt kendt for at hjælpe med at folde proteiner inde i cellen. Når den slukker for TG2, det gør det uden for cellerne, rejser flere spørgsmål om dets funktioner hos raske mennesker.
"Ingen forstår rigtigt, hvordan (Erp57) kommer uden for cellen, " sagde Khosla. "Den generelle tankegang er, at det eksporteres fra cellen i små mængder; denne særlige observation tyder på, at den faktisk har en biologisk rolle uden for cellen."
TG2 er nu også det første protein, der er kendt for at have en reversibel disulfidbinding af denne type. "Dette er en meget anderledes form for on-and-off kemi end den slags, medicinske kemikere (typisk) ville bruge, " sagde Khosla.
Forståelsen af denne mekanisme har fået holdet til at undersøge, om der er nogen FDA-godkendte lægemidler, der kunne målrette skiftet direkte. Fordi tidligere undersøgelser har antydet, at mangel på TG2 ikke ser ud til at påvirke musenes helbred negativt, blokering af TG2 er en lovende vej til behandling af cøliakipatienter uden at kræve livslange ændringer i deres kostvaner.
 Varme artikler
Varme artikler
-
 Fremstilling af F-18 radiofarmaka til PET-billeddannelseKredit:CC0 Public Domain For nylig har ANSTO-forskere gjort fremskridt med at undersøge forbedrede måder at lave livreddende radiofarmaka på ved hjælp af fluor-18 radioisotopen, så de kan fås på f
Fremstilling af F-18 radiofarmaka til PET-billeddannelseKredit:CC0 Public Domain For nylig har ANSTO-forskere gjort fremskridt med at undersøge forbedrede måder at lave livreddende radiofarmaka på ved hjælp af fluor-18 radioisotopen, så de kan fås på f -
 Forskere forbedrer metoden til at sondere halvledende krystaller med lys for at opdage defekter og u…Prøven placeres uden for den integrerende kugle og på en aluminiumsplade forbundet til en køleanordning. Kredit:Tohoku University Forskere fra Tohoku University har forbedret en metode til at sond
Forskere forbedrer metoden til at sondere halvledende krystaller med lys for at opdage defekter og u…Prøven placeres uden for den integrerende kugle og på en aluminiumsplade forbundet til en køleanordning. Kredit:Tohoku University Forskere fra Tohoku University har forbedret en metode til at sond -
 Udfordrer en central grundsætning i kemiKredit:CC0 Public Domain Steve Granick, Direktør for IBS Center for Soft and Living Matter og Dr. Huan Wang, Seniorforsker, rapport sammen med 5 tværfaglige kolleger i tidsskriftets 31. juli-udgav
Udfordrer en central grundsætning i kemiKredit:CC0 Public Domain Steve Granick, Direktør for IBS Center for Soft and Living Matter og Dr. Huan Wang, Seniorforsker, rapport sammen med 5 tværfaglige kolleger i tidsskriftets 31. juli-udgav -
 Fra krystaller til briller:en ny samlet teori for varmetransportVarme strømmer fra varmere til køligere områder af amorft silicium. Kredit:Leyla Isaeva Teoretiske fysikere fra SISSA og University of California i Davis har udviklet en ny tilgang til varmetransp
Fra krystaller til briller:en ny samlet teori for varmetransportVarme strømmer fra varmere til køligere områder af amorft silicium. Kredit:Leyla Isaeva Teoretiske fysikere fra SISSA og University of California i Davis har udviklet en ny tilgang til varmetransp
- Usædvanlig struktur af gigantisk radiogalakse J0133−1302 opdaget af astronomer
- Kan vi virkelig standse koralrevskatastrofen?
- Den berømte røde stjerne Betelgeuse snurrer hurtigere end forventet; kan have slugt en ledsager 10…
- Hvad er perceptuelle illusioner?
- Sjove ting at gøre i en tempereret løvskov
- For identiske kvantekanaler, ordensspørgsmål


