Forskere identificerer molekylær struktur af GATOR1 -proteinkomplekset, der regulerer cellulære vækstsignaler
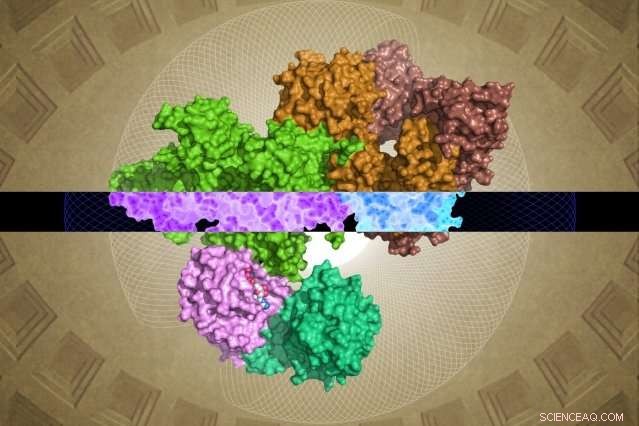
Den cryo-EM-genererede GATOR1-struktur kan give indsigt i dens funktion. Kredit:Steven Lee/Whitehead Institute
Et team af forskere fra Whitehead Institute og Howard Hughes Medical Institute har afsløret strukturen af et vigtigt proteinkompleks hos mennesker, der transmitterer signaler om næringsstofniveauer, gør det muligt for celler at tilpasse deres vækst til forsyningen af materialer, der er nødvendige for at understøtte denne vækst. Dette kompleks, kaldet GATOR1, fungerer som en slags tænd / sluk-knap for signalerne "vokse" (eller "vokser ikke"), der strømmer gennem en kritisk cellulær vækstvej kendt som mTORC1.
På trods af dens betydning, GATOR1 ligner lidt kendte proteiner, efterlader store huller i forskernes forståelse af dets molekylære struktur og funktion. Nu, som beskrevet online den 28. marts i journalen Natur , Whitehead -forskere og deres kolleger har genereret det første detaljerede molekylære billede af GATOR1, afslører en stærkt ordnet gruppe proteiner og en ekstremt usædvanlig interaktion med sin partner, Rag GTPase.
"Hvis du ved noget om et proteins tredimensionelle struktur, så kan du lave nogle velinformerede gæt om, hvordan det kan fungere. Men GATOR1 har dybest set været en sort boks, "siger seniorforfatter David Sabatini, medlem af Whitehead Institute, professor i biologi ved MIT, og efterforsker med Howard Hughes Medical Institute (HHMI). "Nu, for første gang, Vi har genereret billeder i høj opløsning af GATOR1 og kan begynde at dissekere, hvordan dette kritiske proteinkompleks fungerer. "
GATOR1 blev første gang identificeret for omkring fem år siden. Den består af tre proteinunderenheder (Depdc5, Nprl2, og Nprl3), og mutationer i disse underenheder er blevet forbundet med menneskelige sygdomme, herunder kræft og neurologiske tilstande såsom epilepsi. Imidlertid, på grund af den manglende lighed med andre proteiner, størstedelen af GATOR1 -komplekset er et molekylært mysterium. "GATOR1 har ingen veldefinerede proteindomæner, "forklarer Whitehead -forsker Kuang Shen, en af undersøgelsens første forfattere. "Så, dette kompleks er virkelig ganske specielt og også meget udfordrende at studere. "
På grund af kompleksets store størrelse og relative fleksibilitet, GATOR1 kan ikke let krystalliseres - et nødvendigt trin for at løse proteinstruktur gennem standard, Røntgenkrystallografiske metoder. Som resultat, Shen og Sabatini henvendte sig til HHMI's Zhiheng Yu. Yu og hans team har specialiseret sig i kryo-elektronmikroskopi (kryo-EM), en ny teknik, der lover at visualisere molekylære strukturer af store proteiner og proteinkomplekser. Vigtigere, det udnytter ikke proteinkrystaller. I stedet, proteiner fryses hurtigt ned i et tyndt lag af forglaset is og derefter afbildes af en stråle af hurtige elektroner inde i en elektronmikroskopsøjle.
"Der har været nogle store fremskridt inden for cryo-EM-teknologi i løbet af det sidste årti, og nu, det er muligt at opnå atomær eller nær atomopløsning for en række proteiner, "forklarer Yu, en seniorforfatter af papiret og direktør for HHMI's delte, state-of-the-art cryo-EM facilitet på Janelia Research Campus. Sidste års Nobelpris i kemi blev tildelt tre forskere for deres banebrydende indsats for at udvikle cryo-EM.
GATOR1 viste sig at være et vanskeligt emne, selv for cryo-EM, og krævede nogle forsøg og fejl fra Yus side, Shen, og deres kolleger til at udarbejde prøver, der kunne give robust strukturel information. I øvrigt, teamets arbejde blev endnu vanskeligere af kompleksets unikke form. Uden indtryk af GATOR1s potentielle struktur, Shen og hans kolleger, herunder medforfatter Edward Brignole fra MIT, måtte udlede det helt fra bunden.
Alligevel, Whitehead-HHMI-teamet var i stand til at løse næsten komplette strukturer for GATOR1 såvel som for GATOR1 bundet til sine partnerproteiner, Rag GTPases. (To områder af underenheden Depdc5 er meget fleksible og kan derfor ikke løses.) Fra denne rigdom af ny information samt fra teamets efterfølgende biokemiske analyser, nogle overraskende fund dukkede op.
Først er det bemærkelsesværdige organisationsniveau for GATOR1. Proteinet er ekstremt velorganiseret, hvilket er ret usædvanligt for proteiner, der ikke har nogen forudsagte strukturer. (Sådanne proteiner er normalt ret uorganiserede.) Desuden er forskerne identificerede fire proteindomæner, der aldrig før er blevet visualiseret. Disse nye motiver - kaldet NTD, SABA, SHEN, og CTD - kunne give afgørende indsigt i det indre arbejde i GATOR1 -komplekset.
Shen, Sabatini, og deres kolleger afslørede endnu en overraskelse. I modsætning til andre proteiner, der binder til Rag GTPases, GATOR1 kontakter disse proteiner på mindst to forskellige steder. I øvrigt, et af bindingsstederne tjener til at hæmme - snarere end at stimulere - aktiviteten af Rag GTPase. "Denne form for dobbeltbinding er aldrig blevet observeret - det er yderst usædvanligt, "Siger Shen. Forskerne antager, at denne funktion er en af grundene til, at GATOR1 er så stor - fordi den skal holde sin Rag GTPase på flere steder, frem for en, som de fleste andre proteiner af denne type gør.
På trods af disse overraskelser, forskerne erkender, at deres analyser kun er begyndt at ridse overfladen af GATOR1 og de mekanismer, hvormed den regulerer mTOR -signalvejen.
"Der er meget tilbage at opdage i dette protein, "Siger Sabatini.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT -forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar
Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar -
 Kemikere udvikler en enkel, let at bruge metode til at nedbryde forurenende stoffer i vandKredit:George Hodan/public domain Kemikere fra Martin Luther University Halle-Wittenberg (MLU) har bestemt, hvordan genstridige forurenende stoffer i vand let kan opløses og omkostningseffektivt.
Kemikere udvikler en enkel, let at bruge metode til at nedbryde forurenende stoffer i vandKredit:George Hodan/public domain Kemikere fra Martin Luther University Halle-Wittenberg (MLU) har bestemt, hvordan genstridige forurenende stoffer i vand let kan opløses og omkostningseffektivt. -
 Banebrydende teknik baner vej for hurtig og billig fremstilling af hurtige medicinske diagnostiske v…Eksempel 100-mikron brede 3D-printede mikrokanalstilladser, vist ved siden af en 20p -mønt - omkostningerne ved at udskrive 1000 af disse kanaler. Kredit:University of Bristol Ny teknologi udvik
Banebrydende teknik baner vej for hurtig og billig fremstilling af hurtige medicinske diagnostiske v…Eksempel 100-mikron brede 3D-printede mikrokanalstilladser, vist ved siden af en 20p -mønt - omkostningerne ved at udskrive 1000 af disse kanaler. Kredit:University of Bristol Ny teknologi udvik -
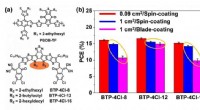 Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
- Økonomisk sværvægter Boeing hamret af dobbelte kriser
- Nanolægemidler:Uopløselige lægemidler kan gøres oralt tilgængelige, hvis de er i nanokrystalfor…
- Indien fører verden i forureningsrelaterede dødsfald:undersøgelse
- Flydende krystaller i nanoporer producerer et overraskende stort undertryk
- Et nyt blødt magnetisk materiale kunne muliggøre hurtigere computerhukommelse
- Vandenberg Air Force Base omdøbes til Space Force Base


