Bakteriel adhæsion in vitro og in silico
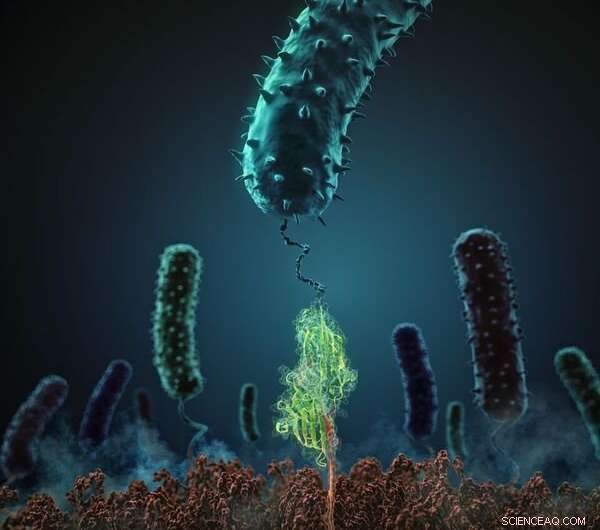
Denne figur viser, hvordan stafylokokker adhæsionsprotein (i grønt) interagerer med dets beslægtede peptidligand (rød). Kredit:H. Gaub, LMU München
Ludwig-Maximilians-Universitaet (LMU) forskere i München, Tyskland, har karakteriseret den fysiske mekanisme, der gør det muligt for et udbredt bakterielt patogen at klæbe til vævene i sin menneskelige vært.
Bakterielle patogener har udviklet meget effektive strategier, der gør dem i stand til at hæfte sig til målceller og nicher i vævene i deres værtsorganismer. De gør endda brug af relativt ukendte fysiske principper, som en ny undersøgelse i tidsskriftet Videnskab demonstrerer. I samarbejde med forskere ved University of Illinois i Urbana-Champaign, Lukas Milles og professor Hermann Gaub fra Det Fysiske Fakultet ved LMU har afsløret den mekanisme, der tillader bakterien Staphyloccus epidermidis at binde sig så ihærdigt til værtsvæv. Ja, Teamet har ikke kun identificeret det fysiske grundlag for interaktionen, men karakteriserede også vedhæftningsmekanismen i hidtil usete detaljer.
Denne bedrift blev muliggjort af den nye tostrengede tilgang, der blev brugt i undersøgelsen. Forskerne brugte atomkraftmikroskopi til at måle bindingskraften mellem et staphylococcus adhæsionsprotein (SdrG fra Staphylococcus epidermidis) og dets beslægtede ligand (fibrinogen β) på enkelt-molekyle niveau in vitro, og beregnede bidragene fra alle de atomer, der er involveret i interaktionen i silico, ved hjælp af en særlig kraftfuld supercomputer. "Dette innovative paradigme giver indsigt, som tidligere var uopnåelig, " påpeger Gaub. For at dissekere adhæsionsmekanismen, Blue Waters supercomputer ved University of Illinois, med sine 900, 000 processorer en af de mest avancerede i verden, udført detaljerede simuleringer af molekylær dynamik. Vedholdenheden i samspillet overraskede holdet. "Den mekaniske bindingskraft, der holder komponenterne i et enkelt kompleks sammen, udgør mere end 2 nanonewton (nN). Dette er en ekstraordinær værdi for en ikke-kovalent interaktion, sammenlignelig med styrken af de kovalente bindinger mellem atomer, som er de mest stabile molekylære bindinger vi kender til, " siger Gaub.
Undersøgelsen viser, at takket være interaktionens geometri, adhæsionsproteinet danner et tæt netværk af ikke-kovalente hydrogenbindinger med dets ligand. I øvrigt, dette netværk medieres af peptidbindingerne, der udgør proteinets gentagne rygrad, snarere end de variable sidekæder, der differentierer dens aminosyreunderenheder. Det store antal involverede lokale interaktioner fører til en stivning af hver brintbinding, hvilket giver anledning til det, fysikere omtaler som 'en kooperativ forskydningsgeometri'. "Denne form for struktur kan modstå ekstreme belastninger, fordi alle de individuelle bindinger skal brydes på én gang for at adskille komplekset, " som Lukas Milles forklarer. Mekanismen er analog med samspillet mellem de mange små kroge og løkker på to velcrobånd, som er ekstremt svære at adskille, når de trækkes fra modsatte ender. "Bakterien gør brug af en meget usædvanlig mekanisme, hvilket er både ekstremt indviklet og yderst effektivt, og giver patogenet en afgørende fordel, " siger Gaub. Da mekanismen er baseret på peptidrygraden i de interagerende molekyler, som er fælles for alle proteiner, dette stabilitetsniveau kan opnås i samspil med et bredt spektrum af mål. Med andre ord, den ekstremt høje mekaniske styrke af interaktionen er stort set uafhængig af både aminosyresekvensen af adhæsionsproteinet og de biokemiske egenskaber af målpeptidet.
Stafylokokker er ansvarlige for en lang række infektioner hos dyr og mennesker. "Patogene bakterier binder sig til målmolekyler på værtsceller med usædvanlig persistens, og dette har sit grundlag i fysiske principper. I søgen efter måder at blokere invasive infektioner, en bedre forståelse af de involverede fysiske principper er afgørende, " siger Hermann Gaub. Således, det nye studie lægger grundlaget for udviklingen af nye terapier til behandling af stafylokokkinfektioner.
Sidste artikelPåvisning af en ny reaktionsvej i atmosfæren
Næste artikelAnti-aging protein alpha Klothos molekylær struktur afsløret
 Varme artikler
Varme artikler
-
 Hudcremer er ikke, hvad vi troede, de varModel af den molekylære struktur af en creme, med atomerne af et overfladeaktivt stof og co-overfladeaktivt stof i lamellen vist i lys og mørkegrå i midten af billedet, og atomer af et konserverings
Hudcremer er ikke, hvad vi troede, de varModel af den molekylære struktur af en creme, med atomerne af et overfladeaktivt stof og co-overfladeaktivt stof i lamellen vist i lys og mørkegrå i midten af billedet, og atomer af et konserverings -
 Forskere udvikler katalysator, der efterligner fotosyntesens Z-skemaCu2O (til højre), der gennemgår fotokorrosion i forhold til Cu2O/TiO2 (til venstre), der fungerer under en Z-ordning for at reducere CO2. Kredit:Ruixin Zhou Et team af kemikere fra University of K
Forskere udvikler katalysator, der efterligner fotosyntesens Z-skemaCu2O (til højre), der gennemgår fotokorrosion i forhold til Cu2O/TiO2 (til venstre), der fungerer under en Z-ordning for at reducere CO2. Kredit:Ruixin Zhou Et team af kemikere fra University of K -
 Australske forskere satte rekord for kuldioxidopsamlingKredit:CC0 Public Domain Forskere fra Monash University og CSIRO har sat rekord for kuldioxidopsamling og -lagring (CCS) ved hjælp af teknologi, der ligner en svamp fyldt med små magneter. Ved at
Australske forskere satte rekord for kuldioxidopsamlingKredit:CC0 Public Domain Forskere fra Monash University og CSIRO har sat rekord for kuldioxidopsamling og -lagring (CCS) ved hjælp af teknologi, der ligner en svamp fyldt med små magneter. Ved at -
 Gennembrud af kemisk syntese lover fremtiden for antibiotikaKredit:CC0 Public Domain University of Colorado Boulder kemiforskere har udviklet en ny måde at syntetisere og optimere en naturligt forekommende antibiotisk forbindelse, der en dag kan bruges til
Gennembrud af kemisk syntese lover fremtiden for antibiotikaKredit:CC0 Public Domain University of Colorado Boulder kemiforskere har udviklet en ny måde at syntetisere og optimere en naturligt forekommende antibiotisk forbindelse, der en dag kan bruges til
- Forebyggelse af cybersikkerhedsangreb ligger i strategiske, tredjepartsinvesteringer, undersøgelse …
- Sådan jager Wild Hogs
- Siemens, Orascom skal genopbygge det store kraftværk i Irak
- Hvordan fungerer et remskivesystem?
- Polymerer i meteoritter giver spor til det tidlige solsystem
- Faktorer, der påvirker et valgsted til en vandkraftstation


