Langt søgt struktur af telomerase baner vej for nye lægemidler til aldring, Kræft
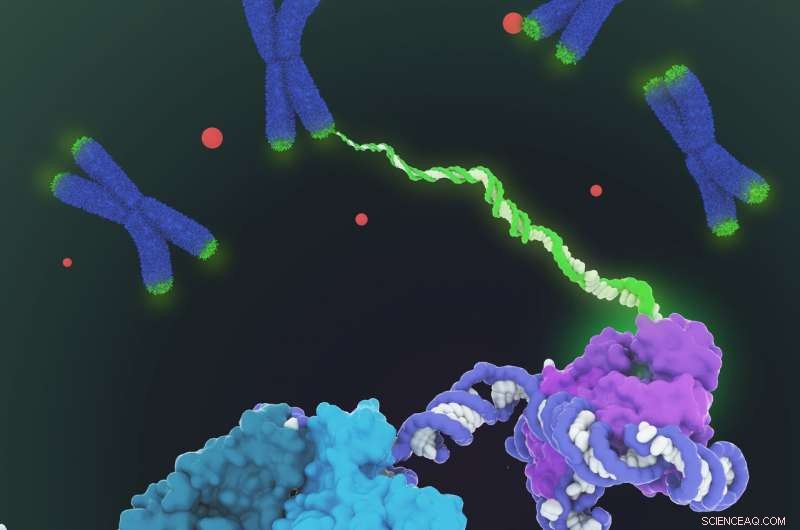
Vist er den rumfyldende model af human telomerase-holoenzymstruktur bestemt ved kryo-elektronmikroskopi (cryo-EM). Telomerase katalyserer syntesen af telomerisk DNA (grøn) i enderne af kromosomerne (blå) for at kompensere for tabet af telomerer under genomreplikation. Strukturen omfatter to lober med forskellige funktioner:den katalytiske kerne (lilla), der er ansvarlig for DNA -syntese og en H/ACA -ribonukleoprotein -lap (cyan, blågrøn og lysegrøn) vigtig for telomerasebiogenese og lokalisering til Cajal-kroppen (røde prikker og nederst til venstre i nærbillede). I betragtning af at telomeraseregulering er impliceret i kræft og aldring, denne første arkitektoniske visualisering af human telomerase repræsenterer et vigtigt gennembrud inden for telomeraseområdet og telomerase-baseret terapeutisk design. Kredit:Janet Iwasa
For mere end 30 år siden, når University of California, Berkeley-forskere opdagede telomerase - et enzym, der forlænger kromosomender og forhindrer dem i at flosse nok til at dræbe en celle - spekulationerne løb løbsk om dets rolle i aldring og kræft. sætte gang i en fuldbanepresse for at producere stoffer til at aktivere eller blokere enzymet.
Selvom hverken telomerase-baserede anti-aging lægemidler, udråbt som en "ungdommens kilde, "og heller ikke kræftmedicin er endnu dukket op, offentliggørelsen i dag af forskere fra UC Berkeley om det første detaljerede billede af den molekylære struktur af menneskelig telomerase bør starte denne indsats, muliggør mere målrettede lægemiddelscreeninger og intelligent design af nye lægemidler.
"Det har været længe undervejs. Det krævede meget vedholdenhed, "sagde Kathleen Collins, en professor i molekylær- og cellebiologi ved UC Berkeley, som har arbejdet på enzymet i 26 år.
Collins og Eva Nogales, også professor i molekylær og cellebiologi, er seniorforfatterne til et papir, der beskriver den 3-D-molekylære struktur af det humane telomerase-enzym, offentliggjort i denne uge i tidsskriftet Natur .
En flaskehals har været at få rene prøver af dette komplekse molekyle, som er sammensat af en RNA -rygrad, dekoreret af seks proteintyper, der bevæger sig rundt, når de tilføjer DNA til enderne af kromosomer. Laboratorier rundt om i verden har diskuteret, om enzymet fungerer enkeltvis eller som sammenføjede tvillinger, og hvordan og hvor mange proteiner dekorerer RNA-rygraden.
Uden konsensus om disse spørgsmål, det har vist sig vanskeligt at designe et lægemiddel til at målrette den molekylære maskine og enten ødelægge telomeraseaktivitet - hvilket kunne stoppe en kræftsygdom, der har øget dens telomeraseniveauer - eller genstarte telomerase, måske for at forberede kroppen til hurtig celledeling efter en knoglemarvstransplantation.
Den nyligt afslørede struktur mangler stadig fine detaljer, men kombineret med viden om gensekvensen af human telomerase, det giver nok information til at begynde at tænke på potentielle mål for narkotika, sagde førsteforfatter Thi Hoang Duong "Kelly" Nguyen, en Miller Institute postdoc-stipendiat ved UC Berkeley.
"De bedste tidligere billeder af human telomerase havde en opløsning på kun 30 Ångstroms; vi var i stand til at få omkring 7 til 8 Ångstroms -opløsning ved hjælp af kryoelektronmikroskopi, " sagde Kelly. "Da jeg kom til det punkt, hvor jeg kunne se alle underenhederne - vi havde 11 proteinunderenheder i alt - var det et øjeblik, 'Wow, wow, sådan passer de alle sammen.'"
Nguyen, Collins og Nogales arbejder aktivt på at forbedre opløsningen til 3 eller 4 Ångstroms - omtrent på størrelse med to carbonatomer - hvilket er tilstrækkeligt til lægemiddeldesign.
Telomerase fylder telomererne op
Telomerer blev først opdaget på molekylært niveau i slutningen af 1970'erne af Elizabeth Blackburn, derefter på UC Berkeley og nu emeritus -præsident for Salk Institute for Biological Studies i La Jolla, Californien. Arbejde med den cilierede protozo Tetrahymena, hun og kolleger viste, at enderne af kromosomerne er afgrænset af gentagne sekvenser af DNA. Bevæbnet med kendskab til telomere sekvens, forskere viste derefter, at telomerer i væv fra flercellede organismer bliver kortere, hver gang en celle deler sig. Telomererne beskytter DNA-strengene mod at flosse og blive beskadiget i deres ender, meget gerne plastspidsen for enden af et snørebånd. Det faktum, at de falder fra med hver celledeling, menes at beskytte os mod kræft, når en celle bliver kapret og prolifererer konstant.
I 1985 på UC Berkeley, Blackburn og den daværende kandidatstuderende Carol Greider opdagede telomerase, et enzym, der tilføjer DNA tilbage til enderne af kromosomerne, forlænge dem og forlænge cellens levetid. Sort brændt, Greider og en anden kollega, Jack Szosak, delte Nobelprisen i fysiologi eller medicin i 2009 for opdagelsen af telomerase.
Forskere har siden fundet ud af, at hos mennesker og andre flercellede organismer, telomerase udtrykkes kun i embryoet, ikke i de fleste voksne celler. Det betyder, at de fleste celler ved fødslen har en forudbestemt evne til at vokse og dele sig, hvorefter de dør. Mange forskere mener, at udtømte telomerer er en væsentlig årsag til aldring.
Collins har forsøgt at bestemme strukturen af telomerase lige siden det første humane telomeraseprotein blev opdaget i 1997, og hun og hendes kolleger har opdaget og omfattende karakteriseret mange af proteinerne i det store enzym, samt den opbrudte hårnålestruktur af telomerasens RNA-rygrad. Men hvordan de alle passede sammen var en gåde på grund af modstridende resultater fra mange forskellige laboratorier.
Nguyen var i stand til at isolere det aktive enzym og rense det meget bedre end nogen havde før, og ansat en ny, state-of-the-art kryoelektronmikroskop til at bestemme strukturen af den aktive telomerase entydigt. Cryo-EM er en teknik til bestemmelse af molekylære strukturer af forbindelser, der ikke kan krystalliseres og afbildes med røntgenstråler, og dets udviklere vandt 2017 Nobelprisen i kemi.
Da UC Berkeley-teamet havde strukturen, Nguyen sagde, det blev klart, hvorfor genetiske mutationer i nogle af proteinerne i telomerase interfererer med enzymet og forårsager sygdom. I 1999 Collins opdagede den første kendte menneskelige sygdom forårsaget af en telomerasemutation:en mutation i et telomeraseprotein kaldet dyskerin, der er ansvarlig for en sjælden sygdom kaldet dyskeratosis congenita. Patienter udvikler anæmi samt hud- og tarmproblemer, og dør oftest af knoglemarvssvigt.
Grunden, Collins siger, er, at der er to dyskerin-molekyler bundet til RNA-rygraden, som ikke kun skal nå ud til netværket af andre proteiner, men også skal røre hinanden, og sygdomsfremkaldende mutationer forhindrer disse koblinger, ødelægger RNA -rygradens evne til at overleve i celler. Nogle børn med dyseratosis congenita har telomeraseniveauer omkring 25 procent af det normale og en levetid på mindre end to årtier. Dem med halvdelen af det normale niveau af telomerase når typisk en helbredskrise midt i livet.
Collins er ekstatisk over endelig at have en endelig struktur for telomerase og ser frem til at lære mere om den indviklede samlingsproces for et af de mest komplekse enzymer i kroppen:en så kompliceret polymerase som ribosomet, som læser RNA for at producere proteiner.
"Jeg troede ikke, det ville være så kompliceret, da jeg besluttede at studere dette molekyle, "sagde hun." Jeg blev nysgerrig efter, hvordan telomerase fungerer i 1991, da jeg lige var færdig som studerende, og jeg ledte efter et virkelig simpelt polymerasesystem til at forstå nukleinsyreinteraktioner. Og jeg tænkte, min gud du kan ikke være enklere end dette. Det var super naivt."
Sidste artikelHvordan livets byggesten kan dannes i rummet
Næste artikelAt finde spormateriale i affaldsmaterialer
 Varme artikler
Varme artikler
-
 Upcycling af fast fashion for at reducere spild og forureningGenbrug af bomuld-polyestertøj er tættere på virkeligheden med en ny metode, der kan (1) opløse de blandede materialer, (2) adskiller cellulosen og (3) centrifugerer nye lyocell-lignende fibre. Kredit
Upcycling af fast fashion for at reducere spild og forureningGenbrug af bomuld-polyestertøj er tættere på virkeligheden med en ny metode, der kan (1) opløse de blandede materialer, (2) adskiller cellulosen og (3) centrifugerer nye lyocell-lignende fibre. Kredit -
 Blæksprutte inspireret klæbemiddel fungerer under vandOctopus vulgaris. Billede:Wikipedia. (Phys.org) – Et team af forskere ved Sungkyunkwan University i Sydkorea har udviklet en type klæbeplaster, der fungerer under en række forskellige forhold, her
Blæksprutte inspireret klæbemiddel fungerer under vandOctopus vulgaris. Billede:Wikipedia. (Phys.org) – Et team af forskere ved Sungkyunkwan University i Sydkorea har udviklet en type klæbeplaster, der fungerer under en række forskellige forhold, her -
 Håndholdt spektralanalysator gør smartphonen til et diagnostisk værktøjDen spektrale transmissions-reflektans-intensitet (TRI) -analysator fastgøres til en smartphone og analyserer patientblod, urin, eller spytprøver lige så pålideligt som klinikbaserede instrumenter, de
Håndholdt spektralanalysator gør smartphonen til et diagnostisk værktøjDen spektrale transmissions-reflektans-intensitet (TRI) -analysator fastgøres til en smartphone og analyserer patientblod, urin, eller spytprøver lige så pålideligt som klinikbaserede instrumenter, de -
 En klogere, sikrere måde at bekæmpe korrosion:Forskning viser, at ny korrosionsinhibitor er 10 gan…Testresultater, der viser områder på 1 mm (Intelli-ion) vs. 10 mm (kontrol) krybning i prøver. Kredit:Hexigone Ltd Uafhængig forskning har vist, at en sikrere, smartere korrosionsinhibitor kan bes
En klogere, sikrere måde at bekæmpe korrosion:Forskning viser, at ny korrosionsinhibitor er 10 gan…Testresultater, der viser områder på 1 mm (Intelli-ion) vs. 10 mm (kontrol) krybning i prøver. Kredit:Hexigone Ltd Uafhængig forskning har vist, at en sikrere, smartere korrosionsinhibitor kan bes
- Forskere bruger droner til at fotografere tang:Tidevandszonen fra fugleperspektiv
- Forskere omformer fononernes energilandskab i nanokrystaller
- Skovduff skal overvejes ved kontrolleret afbrænding for at undgå at beskadige træer
- Onlinesøgninger kan reducere disponeret tro på misinformation
- Fakta om cedertræer
- Nanoprobe muliggør måling af proteindynamik i levende celler


