Enzym vedtager dynamisk struktur til at fungere i varmt, salt hav

Forskergruppen, herunder hovedforfatter Masateru Takahashi, modellerede enzymets struktur fra dets proteinsekvens og udførte biokemiske og strukturelle analyser for at forhøre dets fysiske konfiguration. Kredit:KAUST
For mikroberne, der bor i det varme, salte dybder ved Det Røde Hav, livet er en sart evolutionær balancegang. Bare for at disse dyr skal replikere deres DNA kræver et enzym, der er tilpasset både høje temperaturer og høje saltkoncentrationer, to miljøfaktorer, der pålægger selektivt pres at modvirke strukturen af et protein.
Et KAUST-team har nu karakteriseret og konstrueret et DNA-syntetiserende enzym fra en dybhavsmikro, der synes at dele forskellen, er lige stiv nok til termisk tilpasning, men fleksibel nok til at håndtere saltinducerede strukturændringer. Resultaterne afslører, hvordan evolution kan finjustere proteiner til at være ideelt egnet til livet i ekstreme miljøer. I øvrigt, de kunne have praktiske anvendelser til bioteknologi og biomedicinsk forskning.
"Disse egenskaber er tiltalende for næste generations DNA-sekventeringsteknikker, "siger KAUST-professor Samir Hamdan, der overvågede undersøgelsen." Det er absolut værd at lægge en betydelig indsats nu i at undersøge bioteknologipotentialet for DNA-behandlingsenzymer fra disse mikroorganismer. "
Hamdan og hans laboratorium samarbejdede med fakultetsmedlemmer fra andre KAUST-grupper-herunder Rødehavets forskningscenter og Computational Bioscience Research Center-og på tværs af biologiske og fysiske videnskabsafdelinger for at studere et DNA-syntetiserende polymeraseenzym fra en encellet mikrobe fundet levende af Saudi-Arabiens kyst i en saltlage, der var fire gange saltere og 16 gange varmere end gennemsnittet havvand. "Denne polymerase, "siger undersøgelsens hovedforfatter, Masateru Takahashi, en forsker i Hamdans laboratorium, "er den mest salt-tolerante polymerase, der også er termisk stabil."
Forskerne modellerede enzymets struktur ud fra dets proteinsekvens og gennemførte biokemiske og strukturelle analyser for at forhøre dets fysiske konfiguration. De identificerede mange interaktioner mellem modsat ladede områder af proteinet, der gav enzymet form. Imidlertid, overflod af overskydende negativt ladede områder var også med til at skubbe enzymet fra hinanden til en vis grad, giver den strukturel dynamik til at håndtere øgede saltkoncentrationer. Denne fleksibilitet-og efterfølgende saltinduceret stivhed-kan også forklare, hvorfor dette polymeraseenzym har en unik evne til at bruge zinkioner som hjælpermolekyler, i modsætning til de fleste andre DNA-syntetiserende enzymer af sin art.
Med disse indsigter, KAUST-teamet skabte en salt-tolerant hybridversion af en polymerase, som mange biologer allerede bruger til at forstærke DNA til deres eksperimenter. Indsigten hentet fra disse manipulerede enzymer, siger Takahashi, kunne føre til nye reagenser og metoder til bioteknologiindustrien.
 Varme artikler
Varme artikler
-
 Forskere finder nye måder at bruge bioraffinaderikemikalier påSkræddersyede designerbakterier som fremtidige værktøjer i valoriseringen af bioraffinaderi-furaner. Kredit:Jan Deska Forskere fra gruppen Synthetic Organic Chemistry ved Aalto Universitet har e
Forskere finder nye måder at bruge bioraffinaderikemikalier påSkræddersyede designerbakterier som fremtidige værktøjer i valoriseringen af bioraffinaderi-furaner. Kredit:Jan Deska Forskere fra gruppen Synthetic Organic Chemistry ved Aalto Universitet har e -
 Frosset kobber opfører sig som ædelmetal i katalyse:undersøgelseUnik elektronkonfiguration af det 29. element Cu blev exciteret af højenergiplasma, resulterer i variation af dens kemiske egenskaber. Kredit:SUN Jian og YU Jiafeng Som et ikke-ædelt metal, kobber
Frosset kobber opfører sig som ædelmetal i katalyse:undersøgelseUnik elektronkonfiguration af det 29. element Cu blev exciteret af højenergiplasma, resulterer i variation af dens kemiske egenskaber. Kredit:SUN Jian og YU Jiafeng Som et ikke-ædelt metal, kobber -
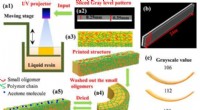 4-D-print, vendbare formændrende materialer med lysbaseret gråtonemønsterGråskala 4D-printmetoden a1) skemaer af metoden med digital lysbehandling (DLP), a2) repræsentativt gråtonemønster til udskrivning, a3) diagrammer af en trykt struktur med forskellig tværbindingstæthe
4-D-print, vendbare formændrende materialer med lysbaseret gråtonemønsterGråskala 4D-printmetoden a1) skemaer af metoden med digital lysbehandling (DLP), a2) repræsentativt gråtonemønster til udskrivning, a3) diagrammer af en trykt struktur med forskellig tværbindingstæthe -
 En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig
En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig
- En model, hvorved planter tilpasser deres fotosyntetiske stofskifte til lysintensiteten
- Matematiske spil, som du kan spille uden en Flash Player
- Pollenbaseret papir lover en ny generation af naturlige komponenter
- Forskere måler den udviklende energi af et soludbrudseksplosiv de første minutter
- Caltech -forskere designer et nyt nanomesh -materiale
- Hvilket vaskemiddel fungerer bedst til et videnskabsmæssigt projekt?


