Producerer gavnlig propylen, mens der forbruges en større drivhusgas
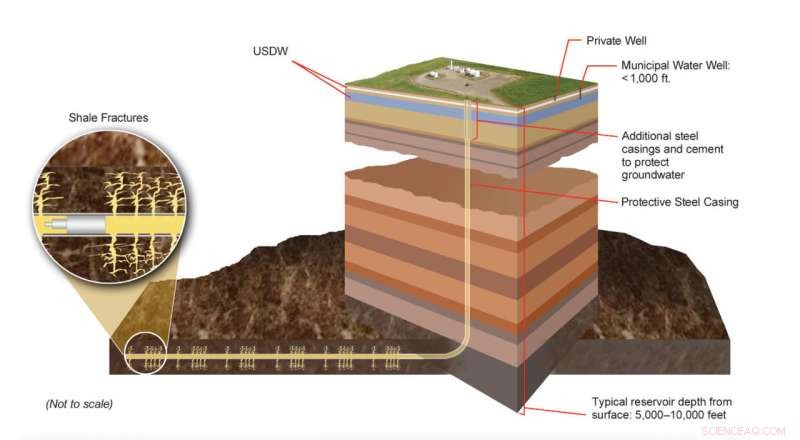
Producerbare dele af skifergasformationer er placeret mange tusinde fod under landoverfladen, langt under underjordiske drikkevandskilder (USDW). Moderne hydraulisk fraktureringsteknologi involverer sofistikerede ingeniørprocesser designet til at skabe forskellige brudnetværk i specifikke klippelag. Eksperter overvåger løbende disse processer for at sikre, at de overholder lokale, stat, og føderale love og regler. Kredit:U.S. DOE
Hvad hvis en større varmefangende drivhusgas kunne forbruges til at producere et værdifuldt kemikalie, der er en mangelvare? Kemikere ved US Department of Energy's (DOE) Brookhaven National Laboratory har identificeret en katalysator - et stof, der fremskynder en kemisk reaktion - som måske er i stand til at gøre netop det. Denne "bimetalliske" katalysator, lavet af jern og nikkel, driver reaktionen af drivhusgassen kuldioxid og den energirige gas propan til fremstilling af propylen. Propylen er en kemisk byggesten, der bruges til fremstilling af mange hverdagsting, inklusive batterier, bildele, og tøj og andre tekstiler.
Propylenproduktionsgabet
Historisk set, propylen har været et biprodukt af dampkrakning - en proces, hvor et råmateriale (råmateriale) blandes med damp og opvarmes til cirka 1500 grader Fahrenheit inde i massive ovne, der "knækker" fra hinanden molekylære bindinger - for at producere ethylen, forløberen for det meste af verdens plastik. Imidlertid, propylen bliver ikke længere samproduceret i de mængder, der er nødvendige for at følge med efterspørgslen. Inden for det seneste årti, skifergas, eller naturgas fra finkornede sedimentære bjergarter, er blevet meget billigt i USA på grund af teknologiske fremskridt inden for fracking. Skifergas består for det meste af metan, men indeholder også fraktioner af ethan og propan. Industrien har draget fordel af denne overflod af billig ethan i råmaterialer til ethylenproduktion, men på bekostning af propylenproduktion.
"Mængden af co-produceret propylen afhænger af den anvendte type råmateriale, og ethandampkrakning er meget selektiv over for ethylen, " sagde Jingguang Chen, som har fælles ansættelser som senior kemiker ved Brookhaven Lab og som Thayer Lindsley professor i kemiteknik ved Columbia University. "Teknologier, der specifikt retter sig mod propylenproduktion, er nødvendige for at udfylde hullet for dette vigtige kemikalie."
En af de eksisterende teknologier er propandehydrogenering, hvor to hydrogenatomer fjernes fra propan (C3H8) for at lave propylen (C3H6). Men denne proces er meget energikrævende på grund af de høje temperaturer, der kræves for at opnå betydelige propylenudbytter. Selvom tilsætning af ilt til propantilførslen sænker den nødvendige mængde energi, i nærvær af overskydende ilt, propan brænder for at danne vand og kuldioxid.
En ny rute for propylenproduktion
I dette studie, forskerne fandt en mere miljø- og energivenlig tilgang ved at introducere kuldioxid som en reaktant, i stedet for et produkt.
"Culdioxid tjener som oxidant, reagerer med propan for at producere propylen, vand, og kulilte, " sagde Elaine Gomez, en ph.d. kandidat i kemiteknik ved Columbia University og medlem af Chens forskningsgruppe. Gomez er den første forfatter på en nylig offentliggjort Naturkommunikation artikel, der beskriver arbejdet.
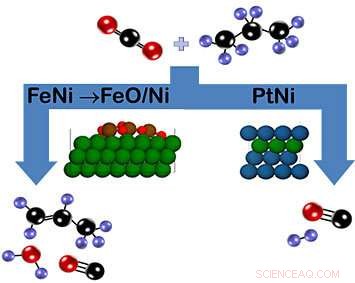
Som vist i skemaet, kuldioxid og propan kan reagere på jern-nikkel (FeNi) katalysatoren for at danne propylen (venstre) eller på platin-nikkel (PtNi) katalysatoren for at danne syngas (højre). I tilfælde af FeNi, et oxidlag af FeO/Ni, der dannes under reaktionen, tilskynder til nedbrydning af CH-bindingen. Derimod PtNi-katalysatoren har ingen oxidfase. Farvenøgle:carbon =sort, oxygen =rød, brint =lilla, nikkel =grøn, jern =brun, platin =blå). Kredit:Brookhaven National Laboratory
For at denne reaktion kan fortsætte, forskerne skulle designe en katalysator, der kunne udføre to funktioner:aktivere kuldioxid (et meget stabilt molekyle) og bryde en kulstof-hydrogen (CH)-binding.
"Fundamentet for vores katalysator er ceriumoxid, eller ceriumoxid, som aktiverer kuldioxid ved frit at udveksle ilt, " forklarede Gomez. "Oven i den støtte, vi tilføjer metallerne jern og nikkel, som kan bryde CH-bindingen."
På baggrund af tidligere arbejde udført af Chens gruppe, holdet havde en anelse om, hvilken katalysator de skulle vælge. Brug af beregningsressourcer på Brookhaven Labs Center for Functional Nanomaterials og Lawrence Berkeleys National Energy Research Scientific Computing Center (begge DOE Office of Science User Facilities), Brookhaven-kemikeren Ping Liu og forskningsmedarbejder Shyam Kattel beregnede mængden af energi, der kræves for, at forskellige trin i den katalytiske reaktion kan fortsætte. Deres beregninger var baseret på røntgenabsorptionsspektroskopiundersøgelser, som Gomez og medforfatterne Bingham Yan og Siyu Yao fra Brookhaven's Chemistry Department udførte ved Stanford Synchrotron Radiation Lightsource ved SLAC National Accelerator Laboratory og Advanced Photon Source ved Argonne National Lab (også DOE) Office of Science User Facilities) for at identificere strukturen og sammensætningen af katalysatorens aktive steder under reaktionsbetingelser. De resulterende spektre afslørede, at overfladen af jern-nikkel-katalysatoren oxideres under reaktionen, og beregningerne viste, at denne jernoxid-nikkel-grænseflade tilskynder til brydning af CH-bindingen.
"En beregningsmetode kaldet tæthedsfunktionel teori [DFT] giver os mulighed for at beregne termodynamikken og kinetikken af reaktionsvejen med en given katalysator for at bestemme, om brud på C-H-bindingen er energetisk gunstig, " sagde Kattel. "DFT forudser, at den jern- og nikkelbaserede katalysator er en god kandidat."
Gomez bekræftede denne forudsigelse gennem flowreaktorundersøgelser, hvor de forskellige reaktantgasser føres fra lagertanke ind i en enkelt ledning, der forbinder til en U-formet glasrørsreaktor. Gasblandingen strømmer i den ene ende af røret og reagerer med den pulverformige katalysator (ved den temperatur katalysatoren er aktiv - i dette tilfælde, omkring 1000 grader Fahrenheit) pakket ind i rørets anden ende. Efterhånden som produkterne kommer frem, en separationsteknik kaldet gaskromatografi kan bruges til at identificere typen og mængden af tilstedeværende kemikalier. Ved at sammenligne mængden af forbrugte reaktanter og fremstillede produkter, forskere kan bestemme katalysatorens selektivitet over for det ønskede produkt. I dette eksperiment, selektiviteten var mere end 50 procent for omdannelse af propan til propylen.
Bruger den samme ceria-støtte, men erstatter jern med platin, forskerne fremmede en anden reaktionsvej, hvor carbon-carbon-bindinger brydes for at producere carbonmonoxid og brint - en kombination kendt som syntesegas (syngas), et mellemprodukt til fremstilling af ammoniak, methanol, og andre kemikalier.
"Begge katalysatorer er aktive ved samme temperatur, men ved at justere deres kemiske sammensætning, vi kan styre reaktionen til at producere propylen eller syngas, " sagde Chen.
"Vi planlægger at bruge vores nuværende dybdegående forståelse af reaktionsmekanismen til yderligere at forbedre omdannelsen af propan til propylen, " sagde Liu. "Denne forståelse muliggør rationel screening af katalysatorer på et teoretisk niveau, og de lovende kandidater vil blive syntetiseret og testet eksperimentelt."
"Vi håber, at industrien og den akademiske verden vil overveje vores nye rute, som forbruger en drivhusgas og kræver mindre energi end traditionelle propylenproduktionsmetoder, " sagde Gomez. "At oversætte vores opdagelse til en kommercialiseret teknologi kan hjælpe med at imødekomme den globale efterspørgsel efter dette kemikalie af høj værdi."
 Varme artikler
Varme artikler
-
 Opbevar håndværksøl på et køligt sted og spis det så frisk som muligtBilledet viser humlekogler. Kredit:Dr. Martin Steinhaus En ny undersøgelse foretaget af Leibniz-Institute for Food Systems Biology ved det tekniske universitet i München (Leibniz-LSB@TUM) viser, a
Opbevar håndværksøl på et køligt sted og spis det så frisk som muligtBilledet viser humlekogler. Kredit:Dr. Martin Steinhaus En ny undersøgelse foretaget af Leibniz-Institute for Food Systems Biology ved det tekniske universitet i München (Leibniz-LSB@TUM) viser, a -
 Prøveopbevaringsmetode kunne forbedre sundhedsplejen i ressourcebegrænsede regionerKredit:offentlig ejendom Blod- og urinprøver spiller vitale roller i moderne medicin. Men i store områder af verden, hvor køling ikke er tilgængelig, at bevare prøver til test er praktisk talt umu
Prøveopbevaringsmetode kunne forbedre sundhedsplejen i ressourcebegrænsede regionerKredit:offentlig ejendom Blod- og urinprøver spiller vitale roller i moderne medicin. Men i store områder af verden, hvor køling ikke er tilgængelig, at bevare prøver til test er praktisk talt umu -
 Lavpris, fluetrædepude-lignende klæbestruktur, der er i stand til gentagen fastgørelse/aftagningElektronmikrografi af fluefoden. De klæbende spatelformede setae (lyseblå strukturer) gør det muligt for fluen at sætte sig fast på genstande. Kredit:Hokkaido University of Education NIMS, HUE og
Lavpris, fluetrædepude-lignende klæbestruktur, der er i stand til gentagen fastgørelse/aftagningElektronmikrografi af fluefoden. De klæbende spatelformede setae (lyseblå strukturer) gør det muligt for fluen at sætte sig fast på genstande. Kredit:Hokkaido University of Education NIMS, HUE og -
 Nye teorier og materialer hjælper overgangen til ren energiIllustration, der fremhæver de tre former for katalyse, der er beskrevet i det nye studie. Kredit:Jason Drees / The Biodesign Institute ved Arizona State University For hver dag der går, den mørke
Nye teorier og materialer hjælper overgangen til ren energiIllustration, der fremhæver de tre former for katalyse, der er beskrevet i det nye studie. Kredit:Jason Drees / The Biodesign Institute ved Arizona State University For hver dag der går, den mørke
- Forskere skaber pansrede emulsioner som små reagensglas til parallelle reaktioner
- Accelereret tørring øger potentielle ildtændinger i hele landet i Texas
- Overlejring af to gitter af lignende perioder for at kontrollere og lokalisere lys
- britiske kirkespir bruges til at booste telefonen, wi-fi signal
- Går supermassive sorte huller sammen og danner binære systemer?
- Googles digitale assistent grener ud til Nest -kamera


